
某合作学习小组讨论辨析以下说法,其中正确的组合是
①SiO2可以制光导纤维;②水玻璃和漂白粉都是混合物;③不锈钢和目前流通的硬币都是合金;
④纯碱和熟石灰都是碱;⑤豆浆和雾都是胶体.
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:单选题




查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
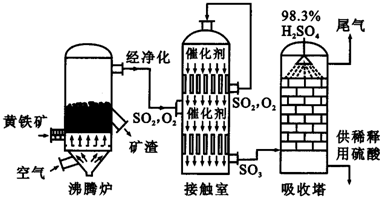
 2Fe2O3+8SO2
2Fe2O3+8SO2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
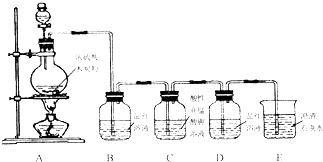
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com