
【题目】消除含氮、硫等化合物的污染对建设美丽家乡,打造宜居环境具有重要意义。
I.用NH3催化还原NOx可以消除氮氧化物的污染,NOx若以NO为例,在恒容容器中进行反应:4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g) ΔH<0。
5N2(g)+6H2O(g) ΔH<0。
(1)以下选项可以判断反应达到平衡状态的是_______。
A..4v正(NH3)=5v逆(N2) B.反应体系中气体密度不变
C..反应体系中气体压强不变 D.反应体系中气体平均摩尔质量不变
(2)图I中曲线表示转化率与反应时间的关系。若改变起始条件,使反应过程由a状态转为b状态进行,可采取的措施是_______

A.降低温度 B.增大反应物中NO的浓度
C.加催化剂 D.向密闭容器中通入氩气
II.燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化的碱吸收法同时脱除SO2和NO工艺,反应进程如图II所示。
反应1:NO(g)+O3(g)![]() NO2(g)+O2(g)
NO2(g)+O2(g)
反应2:SO2(g)+O3(g)![]() SO3(g)+O2(g)
SO3(g)+O2(g)

已知该体系中温度80℃以上臭氧发生分解反应:2O3![]() 3O2。且100℃时臭氧的分解率约为10%。请回答:
3O2。且100℃时臭氧的分解率约为10%。请回答:
(1)写出反应1的热化学方程式_______,反应1在高温下不能自发进行,则该反应的熵变ΔS_______0(填“大于”或“小于”)。
(2)其他条件不变,向五个体积固定为1L的密闭容器中均充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0mol O3,在不同温度下反应相同时间后体系中NO和SO2的转化率如图所示:

①若P、Q两点为非平衡点,试分析P点转化率大于Q点的可能原因_______。100℃,t秒时反应1进行到P点,反应从开始到t秒时NO的平均速率v(NO)=_______mol·L1·s1(用含t的式子表示)。
②若Q点为平衡点,100℃下反应2的平衡常数的数值约为_______(精确到0.01)。
【答案】CD B NO(g)+O3(g)![]() NO2(g)+O2(g) ΔH=199.2kJ·mol1 小于 NO与O3反应的活化能低于SO2与O3反应的活化能或NO与SO2物质本身的性质有关或其它合理答案
NO2(g)+O2(g) ΔH=199.2kJ·mol1 小于 NO与O3反应的活化能低于SO2与O3反应的活化能或NO与SO2物质本身的性质有关或其它合理答案 ![]() 0.96(或0.95)
0.96(或0.95)
【解析】
II(1)根据△H=反应物的总键能-生成物的总键能,计算反应热;根据△G=△H-T△S>0,判断;
(2)根据![]() 计算反应速率;
计算反应速率;
利用![]() 计算平衡常数。
计算平衡常数。
I (1) 4NH3(g)+6NO(g) ![]() 5N2(g)+6H2O(g);
5N2(g)+6H2O(g);
A、达到化学平衡时,正反应速率等于逆反应速率,用不同物质表示时,数值要成比例;选项中有正反应速率,有逆反应速率,但是4υ正(NH3)=5υ逆(N2),表示的正逆反应速率不相等,应该为![]() ,A错误;
,A错误;
B、体积不变,气体的质量不变,根据![]() ,则密度一直不变,则密度不变不能说明达到平衡,B错误;
,则密度一直不变,则密度不变不能说明达到平衡,B错误;
C、恒温恒压下,压强和物质的量成正比,反应前后物质的量在改变,说明压强会变,等压强不变的时候,说明反应达到了平衡,C正确;
D、根据![]() ,气体质量不变,气体物质的量变化,说明平均摩尔质量在变,当平均摩尔质量不变时,说明达到了平衡,D正确;
,气体质量不变,气体物质的量变化,说明平均摩尔质量在变,当平均摩尔质量不变时,说明达到了平衡,D正确;
答案选CD;
(2)a状态转为b状态,由图像可知,b状态达到平衡的时间更短,说明化学反应速率更快,NO的转化率更低,说明a状态到b状态,平衡逆向移动;
A、降低温度,化学反应速率变小,达到平衡的时间变长,不符合题意;B、增大NO的浓度,化学反应速率增大,达到平衡的时间变短,NO的转化率降低,B符合题意;
C、加入催化剂,NO的转化率不变,C不符合题意;
D、向密闭容器中通入氩气,各反应物的浓度不变,则平衡不移动,D不符合题意;
答案选B;
II (1) (1)根据△H=反应物的总键能-生成物的总键能,△H=3.2kJ、mol-202.4kJ·mol-1=199.2KJ·mol1,则反应Ⅰ的热化学方程式为NO(g)+O3(g)![]() NO2(g)+O2(g) ΔH=199.2KJ·mol1;
NO2(g)+O2(g) ΔH=199.2KJ·mol1;
反应1在高温下不能自发进行,则△G>0,根据△G=△H-T△S>0,△H<0,则△S>O;
(2)①NO和SO2均和O3发生反应,但是NO的转化率比SO2转化率高,可能由反应物本身的性质决定的;根据图示,可以知道NO与O3反应的活化能低于SO2与O3反应的活化能,使得NO反应速率快,再与O3反应中,更具优势,反应的更多;答案为NO与O3反应的活化能低于SO2与O3反应的活化能或NO与SO2物质本身的性质有关或其它合理答案;
t秒时反应1进行到P点,NO的转化率为85%,加入了1mol NO,则反应了0.85molNO, ![]() ;
;
②100℃下反应2的平衡常数![]() ,体积为1L。需要知道各物质的物质的量,由于O3和O2涉及到3个反应,要综合计算,
,体积为1L。需要知道各物质的物质的量,由于O3和O2涉及到3个反应,要综合计算,
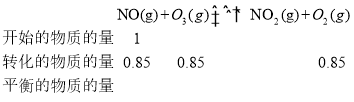
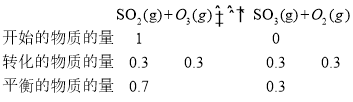
100℃时臭氧的分解率约为10%,

则平衡时O3的物质的量=2mol-0.85mol-0.3mol-0.2mol=0.65mol;平衡时O2的物质的量=0.85mol+0.3mol+0.3mol =1.45mol;则带入数据, 。
。


科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀的说法正确的是( )
A. 金属在潮湿空气中腐蚀的实质是M+nH2O=M(OH)n+![]() H2↑
H2↑
B. 金属的化学腐蚀的实质是M-ne-=Mn+,电子直接转移给氧化剂
C. 金属的化学腐蚀必须在酸性条件下进行
D. 在潮湿的环境中,金属的电化学腐蚀一定是析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的电子式为__。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是__。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为__,通入b气体的电极反应式__。(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在__左右。

②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为__。
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g) ![]() 4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
4C(g),下列叙述能作为该反应达到平衡状态的标志的是( )
A.混合气体的平均摩尔质量不再变化B.v(A)∶v(B)∶v(C)=1∶3∶4
C.混合气体的密度不再变化D.C的体积分数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O5是常用的防腐剂和漂白剂。可利用烟道气中的SO2生产Na2S2O5,其流程如下:
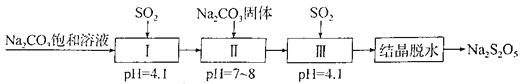
下列说法正确的是
A. 上述制备过程所涉及的物质中只有一种酸性氧化物
B. Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性
C. 上述流程中的Na2CO3饱和溶液和Na2CO3固体不可互换
D. 实验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯六水氯化锶晶体(SrCl2·6H2O)可作有机合成的催化剂。用碳酸锶矿石(含少量BaCO3、FeO、SiO2等杂质)制备高纯六水氯化锶晶体的过程如图所示。
已知:

I.25℃,Ksp[Fe(OH)3]=1.0×10-38 ,Ksp[Fe(OH)2]=1.0×10-16
Ⅱ.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
(1)步骤①中将矿石制成浆液能加快反应速率的原因是_____________________________。
(2)在“浆液”中加入工业盐酸,测得锶的浸出率与温度、时间的关系如图所示:

据此合适的工业生产条件为_________________________。
(3)步骤②“溶液”中加入30%的H2O2,其作用是_____________________________(用离子方程式表示)。
(4)步骤③所得滤渣的主要成分除Fe(OH)3外,还有_______________________(填化学式);25℃,为使Fe3+沉淀完全需调节溶液pH值最小为_____________(当离子浓度减小至1.0×10-5mol·L-1时,可认为沉淀完全)。
(5)关于上述流程中各步骤的说法,正确的是___________(填标号)。
A.步骤④用60℃的热水浴加热蒸发至有晶膜出现
B.步骤④冷却结晶过程中应通入HC1气体
C.步骤⑤干燥SrCl2·6H2O晶体可以采用减压干燥
(6)为测定所得SrCl2·6H2O(Mr=267)晶体样品的纯度,设计了如下方案:称取1.10g样品溶解于适量水中,向其中加入含AgNO31.70g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),C1-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.100 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3溶液,使剩余的Ag+以AgSCN白色沉淀的形式析出,当___________时达到滴定终点,用去NH4SCN溶液20.00 mL,则原SrCl2·6H2O晶体的纯度为________________%(计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

①若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则Y电极上的电极反应式为____________;
②如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是_________,Y电极反应式为__________________(说明:杂质发生的电极反应不必写出)。
(2)NOx、SO2的大量排放是造成大气污染的主要原因,研究其处理方法,将其变废为宝越来越受到人们的重视,按要求回答下列问题。
①富集废气中的SO2,并使其与O2反应可制备硫酸,装置如图所示,X、Y均为多孔电极材料。

Ⅰ气体A是_______,X极的电极反应式为___________________________。
Ⅱ消耗5.6L(标准状况下)气体B时,通过质子交换膜的H+的个数为__________。
②SO2也可用于制备Na2S2O3,但产品常含有杂质。某 SO2制得的此产品,为测其纯度,准确称取Wg该产品,用适量蒸馏水溶解,配成100ml溶液,取20mL,以淀粉作指示剂,用0.2000 molL-1碘的标准溶液滴定。反应原理为: 2S2O32-+I2=S4O62-+2I-。滴定至终点时,溶液颜色的变化:_______________________________。消耗碘的标准溶液体积为20.00mL。求产品的纯度为(设Na2S2O3相对分子质量为M)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与图形相符合的是
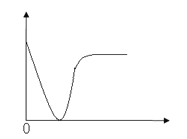
A. 稀盐酸滴加到一定量NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量)
B. 铁粉加到一定量CuSO4溶液中(横坐标是铁粉的质量,纵坐标为沉淀质量)
C. CO2通入一定量NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D. 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为________________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:

图1
实验过程中应将温度控制在________________。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为________________。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是________________。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和________________。


图2 图3
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为________________。
②C点高于B点的原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com