
| A. | 非金属氧化物都不能与酸反应 | B. | 含金属元素的盐溶液一定呈酸性 | ||
| C. | 组成元素相同的盐溶液酸碱性相同 | D. | 非金属元素可能形成离子化合物 |
分析 A.非金属氧化物有还原性氧化物,能与氧化性酸反应;
B.含金属元素的盐溶液可能水解显示碱性;
C.组成元素相同的盐溶液可以形成强酸盐和弱酸盐;
D.铵盐中全部为非金属元素.
解答 解:A.非金属氧化物SO2属于还原性氧化物,能与硝酸反应,故A错误;
B.含金属元素的盐溶液NaAlO2属于强碱弱酸盐,显碱性,故B错误;
C.NaSO4溶液属于强酸强碱盐溶液,显中性,NaSO3溶液属于强碱弱酸盐溶液,显碱性,故C错误;
D.因铵盐中全部为非金属元素,则非金属元素原子能形成离子化合物,故D正确.
故选:D.
点评 本题考查物质性质,明确常见物质的性质即可解答,难度不大,注意常见的物质性质的积累.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题

| A. | 该物质可以与碳酸氢钠反应产生气体 | |
| B. | 该物质可以发生酯化反应 | |
| C. | 此分子应该为某种氨基酸 | |
| D. | 该物质的分子式C3H6O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 所有的吸热反应一定要在加热的条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、NO3-、ALO2- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
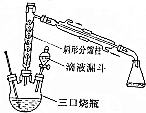 | 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水的溶解性 |
| 乙醇 | 46 | 0.789 | 78.3 | 溶 | |
| 乙酸 | 60 | 1.050 | 117.9 | 溶 | |
| 乙酸乙酯 | 88 | 0.896 | 77.2 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | 测0.1mol•L-1氨水的pH为11,是因为NH2•H2O?NH4++OH- | |
| C. | 0.01mol•L-1NaHCO3溶液中溶质的电离方程式为Na++H++CO32- | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于7 | B. | 等于7 | ||
| C. | 大于7 | D. | 可能等于7,也可能于小于7或大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.
氧化剂H2O2被称为绿色氧化剂,因而受到人们越来越多的关注,某实验小组以过氧化氢分解为例,探究浓度、溶液的酸碱性对反应速率的影响.在常温下按照下表完成实验.| 实验编号 | 反应物 |
| a | 10mL2%H2O2溶液、少量烧碱 |
| b | 10mL2%H2O2溶液 |
| c | 10mL2%H2O2溶液、少量盐酸 |
| d | 10mL5%H2O2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
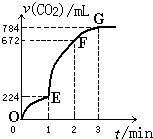 常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).
常温下,用纯净的CaCO3与100mL稀盐酸制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com