
| A. | 电解过程中OH-向阴极迁移 | |
| B. | 阳极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 毎有l mol电子转移,生成标准状况下5.6L气体 | |
| D. | 电解过程中阴极区溶液的pH降低 |
分析 A.电解池中阴离子移向阳极;
B.阳极氢氧根离子失去电子发生氧化反应;
C.依据方程式4ClO3-+2H2O$\frac{\underline{\;通电\;}}{\;}$4ClO2↑+O2↑+4OH-.转移1mol电子生成0.25mol氧气和1mol二氧化氯;
D.阴极氯酸根离子得到电子结合氢离子生成二氧化氯和水.
解答 解:A.氢氧根离子为阴离子,电解过程移向阳极,故A错误;
B.阳极氢氧根离子失去电子发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O,故B正确;
C.依据方程式4ClO3-+2H2O$\frac{\underline{\;通电\;}}{\;}$4ClO2↑+O2↑+4OH-.转移1mol电子生成0.25mol氧气和1mol二氧化氯,生成气体标况下体积28L,故C错误;
D.阴极电极反应式为:4ClO3-+4e-+8H+=4ClO2↑+4H2O,消耗氢离子,溶液pH值增大,故D错误;
故选;B.
点评 本题考查了电解法制备二氧化氯,明确电解池工作原理是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
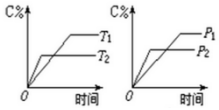 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
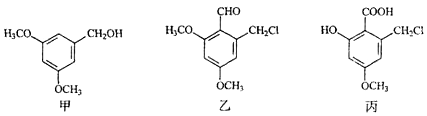
| A. | 甲、乙均能发生加成反应 | |
| B. | 甲的一种同分异构体中可能含有苯环和羧基 | |
| C. | 甲分子中的所有原子可能共平面 | |
| D. | 用酸性KMnO4溶液可鉴别乙和丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发、结晶与蒸发皿 | B. | 过滤与漏斗 | ||
| C. | 萃取、分液与分液漏斗 | D. | 蒸馏与蒸馏装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
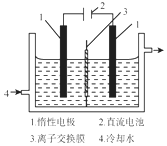 碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.
碘被称为“智力元素”科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.| 试验方法 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微电池的负极是Mg | B. | 微电池的负极是Al | ||
| C. | 铝的电极反应式为2H++2e-═H2↑ | D. | 镁的电极反应式为Mg-2e-═Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一块带有氧化膜的铝片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体 | |
| B. | 向NaAlO2溶液中加入过量的A1C13溶液,将所得沉淀过滤洗涤,加热灼烧去掉水分,可得纯净的A1(OH)3固体 | |
| C. | 把铝块与适量的稀盐酸完全反应,将所得溶液蒸干,可得AlCl3固体 | |
| D. | AlC3溶液与足量氨水反应,将沉淀过滤、洗涤、灼烧去掉水分可得Al2O3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com