

���� ��1����ͼ��֪��������������Һ����ƿ��
��2������װ�õ������Գ��÷���Ϊ�������������������Һ�������γ�Һ��߶Ȳ��װ��ͼ��֪�ʺ�ѡ��Һ�������γ�Һ��߶Ȳһ��ʱ�䣬Һ��߶Ȳ�ֲ��䣬˵�����������ã�ʹװ���ܱգ��ı�B�е�������Һ��Һ��ı仯�����ж�װ�������ԣ�
��3��������������Ư����ʵ��Ӧ���ڹ۲췴Ӧ����
�ڵ�һ�δ�Aƿ���Ͽڳ�����ʹBƿ�е�������Һ���ƽ���ڶ�����Aƿ�ڼ���ϡ��������δ�Aƿ���Ͽڳ�����ʹBƿ�е�������Һ���ƽ��
����Mg��H2�����㣻
��4���ٶ������ܶ���ʱ�����ȵ�ʵ��װ�ûָ��������ٽ�����һ��������Ȼ�����������ʹ����Һ����ƽ��������ʱ�����밼Һ����ʹ���ƽ��������������֮��Ĺ�ϵʽ���������������ٸ�������������ʽ���м��㣻
��Mg��Al�������ᷴӦ���������������������������������
���ݽ��������������ɵ�������м�����Եó���������������
��� �⣺��1����A�����巢������B�Ǵ�Һƿ��C��Һ����ƿ���ʴ�Ϊ��Һ����ƿ��
��2������װ�õ������Եķ����ǣ�����Ƥ����סAƿ���Ͽڣ��۲�Bƿ�г�������Һ������������1���Ӳ��½���֤�����������ã�
�ʴ�Ϊ������Ƥ����סAƿ���Ͽڣ��۲�Bƿ�г�������Һ������������1���Ӳ��½���֤�����������ã�
��3��������������Ư���ԣ�����������Ʒ����Һ������Ӧ���Һ�ɫ�۲���йأ�B��ѡ�õ�Һ����Ʒ����Һ��ԭ����ABC��
�ʴ�Ϊ��ABC��
�ڵ�һ�δ�Aƿ���Ͽڳ�����ʹBƿ�е�������Һ���ƽ���ڶ�����Aƿ�ڼ���ϡ��������δ�Aƿ���Ͽڳ�����ʹBƿ�е�������Һ���ƽ���ʴ�Ϊ��A��B��A��
�۳�ȡmgþ�����ѳ�ȥ��������Ĥ����ϡ���ᷴӦʱ�������������������VL��
��Mg��H2����֪��$\frac{m}{24}$=$\frac{V}{{V}_{m}}$�����Vm=$\frac{24V}{m}$L/mol��
�ʴ�Ϊ��$\frac{24V}{m}$L/mol��
��4���ٸ���PV=nRT��Ϊ��֤���������������ǵ�ʱ����ѹ�µ�������ڶ���ʱӦע�⣺�ٽ�ʵ��װ�ûָ������£���ʹ����������Һ����ƽ����Ϊ��ƽ˵������Һ���ϵ�ѹǿ��һ���ģ����������������������ǵ�ʱ����ѹ�µ�������������밼Һ����ʹ���ƽ�����ӻ����ӻ������
����2OH-+2Al+6H2O=2[AI��OH��4]-+3H2������������֮��Ĺ�ϵʽ֪����������=$\frac{\frac{0.0224L}{22.4L/mol}}{3}$��2��27g/mol=0.018g��
������������=$\frac{0.018g}{0.036g}$��100%=50%��
�ʴ�Ϊ����ʵ��װ�ûָ������£�ʹ������Һ���ˮ��Һ����ƽ�������������ܰ�Һ����ƽ��50%��
��Mg��Al�������ᷴӦ������������������������������������ݽ��������������ɵ�������м�����Եó���������������
�ʴ�Ϊ�������ܣ�
���� ���⿼����������IJⶨʵ��װ�á���ʵ��ԭ����ʵ��װ�õ����⡢Ԫ�ػ��������ʡ�������ɲⶨ����ѧ����ȣ�����Mg���ᷴӦ������������������IJⶨԭ��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�


 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2KNO3+3C+S$\frac{\underline{\;\;��\;\;}}{\;}$K2S+N2��+3CO2�� | B�� | 2NaCl $\frac{\underline{\;���\;}}{\;}$2Na+Cl2�� | ||
| C�� | 2AgNO3$\frac{\underline{\;\;��\;\;}}{\;}$2Ag+2NO2��+O2�� | D�� | 2KMnO4$\frac{\underline{\;\;��\;\;}}{\;}$K2MnO4+MnO2+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
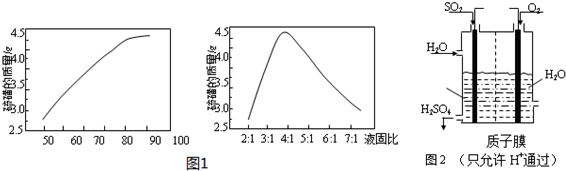
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | �Լ� | ���뷽�� | |
| �� | �屽���壩 | ����������Һ | ��Һ |
| �� | CO2��HCl�� | ����Na2CO3��Һ | ϴ�� |
| �� | �������������ᣩ | NaOH��Һ | ��Һ |
| �� | Cl2��HCl�� | ����NaCl��Һ | ϴ�� |
| A�� | �٢� | B�� | �٢� | C�� | ֻ�� �� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
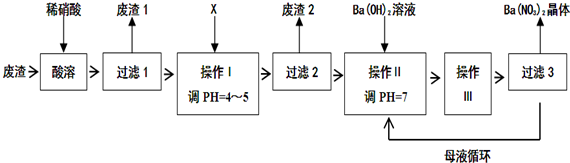
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 4.6g�л���C2H6O�ķ��ӽṹ�к��е�C-H����Ŀһ��Ϊ0.5Na | |||||||||||
| B�� | �ö��Ե缫��������Ȼ�����Һ��������������������Ϊ2gʱ����Һ��ת�Ƶ�����Ϊ2Na | |||||||||||
| C�� | һ���¶��£�����Kw��ʾˮ�����ӻ���Kb��ʾһˮ�ϰ��ĵ��볣��������¶���ˮ��ƽ�ⳣ��K=$\frac{{K}_{W}}{{K}_{b}}$ | |||||||||||
| D�� | ��֪�����ʾ���ݣ�
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ӳɷ�Ӧ | B�� | ˮ�ⷴӦ | C�� | ��ȥ��Ӧ | D�� | ������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ڢ� | C�� | �ڢܢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
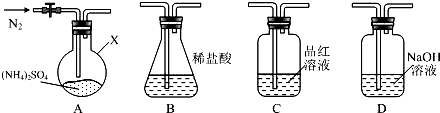
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com