
一定条件下,将Na与O2反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5 mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
科目:高中化学 来源: 题型:
Ⅰ. (1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
(g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是________,NO分子中化学键的键能为________kJ·m ol-1。
ol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.
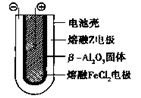
 熔融状态下,
熔融状态下, 钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2  Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为_______ _______________;
_______________;
充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __
查看答案和解析>>
科目:高中化学 来源: 题型:
我国湘黔渝三地交界地区是中国电解锰企业最集中的地区,被称为中国的“锰三角”。金属锰的熔点很高,常用铝热法制得粗锰,再用电解法制得纯的金属锰。铝被用于冶炼金属锰,是因为铝 ( )
A.熔点低
B.具有还原性
C.具有两性
D.冶炼反应中放出大量的热
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”。你知道其中的奥妙吗?请用化学方程式表示其反应原理:
__________________________________________________________________。
(2)铜在自然界多以+1价矿石存在,因为在固态或是高温下+1价铜比+2价铜稳定。辉铜矿(Cu2S)炼铜的方法之一是将矿石高温通空气焙烧,生成两种氧化物。将焙烧过的矿石加上比它质量约少一半的未经焙烧的矿石,混合后隔绝空气再进行高温熔烧,结果得到金属铜和一种具有刺激性气味的气体。这两个反应的化学方程式为 、 。
(3)已知CuS、Cu2S均为黑色不溶于水的固体,在空气中灼烧均生成CuO与SO2,不用其他试剂,设计最简单的实验来鉴别二者: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如右(中间用离子交换膜隔开):
 4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为 m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是 。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组
是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不能达到实验目的的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol·L-1NaOH溶液中先加入3滴1 mol·L-1MgCl2溶液,再加入3滴 1 mol·L-1FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成UV高级油墨的主要成分的路线图如下:
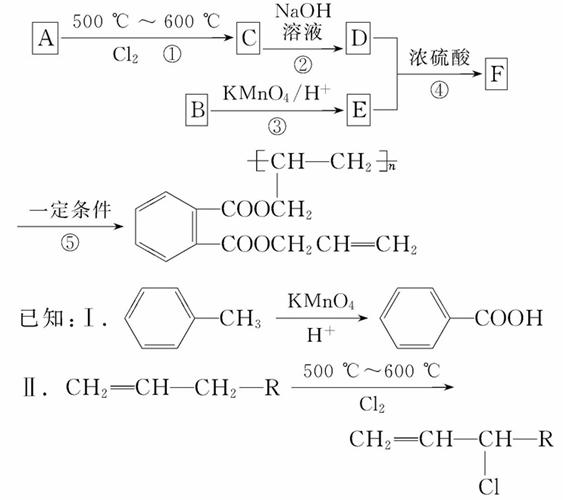
请回答:
(1)A的结构简式为___________________________________________。
(2)下列有关D的说法,正确的是_______(填序号)。
A.能使紫色石蕊试液变红
B.能发生缩聚反应
C.能发生取代反应
D.能发生加成反应
(3)F的官能团有_______种(不含苯环)。1 mol F与氢氧化钠溶液共热,最多能消耗_______mol NaOH。
(4)反应②的化学方程式为_______________________________________。
(5)E有多种同分异构体,写出同时符合以下条件的同分异构体的结构简式_______________________________________。
①与NaHCO3反应能生成CO2气体
②与新制氢氧化铜悬浊液共热能生成红色沉淀
③苯环上的一氯代物只有2种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com