
| A. | 7.8gNa2O2中含有的共价键数为0.2NA | |
| B. | 7.8gNa2S与Na2O2的混合物中含离子总数为0.3NA | |
| C. | 7.8gNa2O2与足量的CO2充分反应,产生O2的分子总数为0.1NA | |
| D. | 0.2molNa被完全氧化生成7.8gNa2O2,转移的电子数目为0.1NA |
分析 A.计算物质的量n=$\frac{m}{M}$,过氧化钠中过氧根离子中含有一个共价键;
B.Na2S与Na2O2的摩尔质量都是78g/mol,硫化钠是2个钠离子和一个硫离子构成,过氧化钠是2个钠离子和一个过氧根离子构成,计算物质的量n=$\frac{m}{M}$,得到离子数;
C.计算过氧化钠物质的量n=$\frac{m}{M}$,依据化学反应定量关系计算;
D.0.2molNa被完全氧化生成7.8gNa2O2,依据0.2mol钠失电子总数计算.
解答 解:A.计算物质的量n=$\frac{m}{M}$=$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中过氧根离子中含有一个共价键,则7.8gNa2O2中含有的共价键数为0.1NA,故A错误;
B.Na2S与Na2O2的摩尔质量都是78g/mol,硫化钠是2个钠离子和一个硫离子构成,过氧化钠是2个钠离子和一个过氧根离子构成,计算物质的量n=$\frac{m}{M}$=$\frac{7.8g}{78g/mol}$=0.1mol,得到离子数为0.3NA,故B正确;
C.计算过氧化钠物质的量n=$\frac{m}{M}$$\frac{7.8g}{78g/mol}$0.1mol,2Na2O2+2CO2=2Na2CO3+O2,化学反应定量关系计算产生O2的分子总数为0.05NA,故C错误;
D.0.2molNa被完全氧化生成7.8gNa2O2,依据0.2mol钠失电子总数计算为0.2NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数应用,主要是过氧化钠结构和微粒数的计算应用,掌握基础是解题关键,题目难度中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SiC>C(金刚石)>Si | B. | Al>Mg>Na | C. | H2O>H2Se>H2S | D. | KCl>NaCl>LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:填空题
煤的直接燃烧会对大气造成严重污染,是雾霾形成的一个重要原因。实现煤的清洁利用迫在眉睫。乙醇、甲醇、尿素等均与煤化工相关。
Ⅰ.(1)将煤转化成水煤气可有效提高能源利用率:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
(2)一定温度下,在体积可变的容器中投入反应物进行此反应,则下列说法正确的是
A.体系中加入催化剂(其他条件保持不变),平衡不移动但反应的ΔH 将变大
B.若正、逆反应比值恒定,则说明平衡已建立
C.建立平衡后,加压,气体的平均相对分子质量将增大
D.建立平衡后,加压,平衡向逆方向移动,平衡常数减小
Ⅱ.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
在一定压强下,测得上述反应的实验数据如下表。
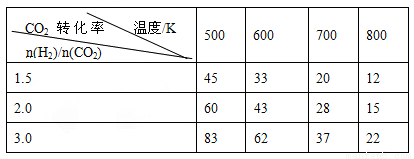
根据表中数据分析:
(3)上述反应的a 0(填“>”“<”或“=”)
(4)在温度为T1时,该反应的平衡常数K=1,在2L密闭容器中加入一定量体系各物质,反应的某时刻测得反应体系中各气体均为1mol。
①此时V(CO2)正= V(CO2)逆(填“>”“<”或“=”)
②若反应在恒压绝热容器中进行,达平衡后,CO2的物质的量
A.大于1mol B.等于1mol C.小于1mol D.不确定
Ⅲ.CO2亦是合成尿素的重要原料,以CO2与NH3为原料合成尿素[化学式为[CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) ΔH=+l59.5kJ·mol-1
②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
下列事实中,不能用勒夏特列原理揭示的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压回颜色变深
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com