
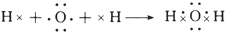 .
.分析 (1)H原子和O原子通过共用电子对形成水分子;
(2)pH=1的溶液呈强酸性,生成气体、沉淀、弱电解质、络合物或发生双水解反应、氧化还原反应的离子之间不能大量共存;
(3)属于氧化还原反应,说明该反应中有电子转移,水制作氧化剂,说明该反应中水中元素得电子化合价降低,水既不是氧化剂又不是还原剂,说明水中各元素化合价不变;
(4)该燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,根据水和转移电子之间的关系式计算转移电子数.
解答 解:(1)H原子和O原子通过共用电子对形成水分子,其形成过程为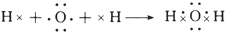 ,
,
故答案为: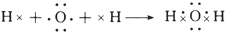 ;
;
(2)pH=1的溶液呈强酸性,①NH4+、Al3+、Br-、SO42- 之间不反应,且和氢离子也不反应,所以能大量共存,故正确;
②强酸性条件下,Fe2+和NO3-能发生氧化还原反应而不能大量共存,故错误;
③K+、Ba2+、Cl-、NO3-之间不反应且和氢离子也不反应,所以能大量共存,故正确;
④HCO3-和氢离子反应生成二氧化碳和水,所以不能大量共存,故错误;
故答案为:①③;
(3)A.2F2+2H2O═4HF+O2 中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水是还原剂;
B.2Na2O2+2H2O═4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为-2价和0价,水中各元素化合价不变,所以水既不是氧化剂又不是还原剂;
C.CaH2+2H2O═Ca(OH)2+2H2↑ 中H元素化合价由-1价、+1价变为0价,所以水是氧化剂、氢化钙是还原剂;
D.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2中Fe元素化合价由0价变为+2价和+3价、H元素化合价由+1价变为0价,所以水是氧化剂、Fe是还原剂,
则水只作氧化剂的是CD、水既不作氧化剂又不作还原剂的是B,
故选CD;B;
(4)该燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=2H2O,电池反应式为2H2+O2=2H2O,1.8L水的质量为1800g,1.8L水的物质的量=$\frac{1800g}{18g/mol}$=100mol,水和转移电子之间的关系式为H2O--2e-,生成100mol水转移电子电子数=100mol×2×NA/mol=200NA,
故答案为:H2-2OH-=2H2O;200NA.
点评 本题考查较综合,涉及氧化还原反应、原电池原理、离子共存等知识点,利用基本原理、基本概念分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
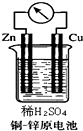 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
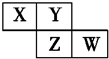 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | 气态氢化物溶液的pH:X>Y>W | |
| D. | Y的氢化物的沸点低于同族元素Z的氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
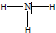 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com