
| A、Na2S水溶液在空气中变浑浊 |
| B、生活中使用明矾净水,除去水中的悬浮颗粒 |
| C、溶有二氧化氮的浓硝酸做火箭的助燃剂 |
| D、漂白粉漂白有色布条 |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
 一定温度下,向2L恒容容器甲中,充入2mol碳和2mol CO2发生如下反应:C(s)+CO2(g)?2CO(g)△H>0,测得容器中CO2的物质的量随时间t的变化关系如图所示.
一定温度下,向2L恒容容器甲中,充入2mol碳和2mol CO2发生如下反应:C(s)+CO2(g)?2CO(g)△H>0,测得容器中CO2的物质的量随时间t的变化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
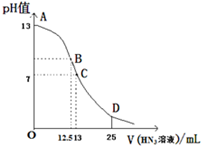 纯叠氮酸(HN3)是无色液体,对热十分稳定,但受撞击就爆炸,常用作引爆剂,如图为常温下向25ml0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1的HN3溶液过程中溶液的pH的变化曲线(溶液混合时体积变化忽略不计).
纯叠氮酸(HN3)是无色液体,对热十分稳定,但受撞击就爆炸,常用作引爆剂,如图为常温下向25ml0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1的HN3溶液过程中溶液的pH的变化曲线(溶液混合时体积变化忽略不计).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀硫酸反应 |
| B、Ba(OH)2?8H2O晶体与氯化铵晶体反应 |
| C、盐酸与氢氧化钠溶液反应 |
| D、乙醇在空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O═Na++OH-+H2↑ |
| B、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++3OH-═Al(OH)3↓ |
| D、Ba(OH)2溶液与H2SO4溶液混合:Ba2++SO42-+OH-+H+═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com