
【题目】某人设计利用方案如下图所示:
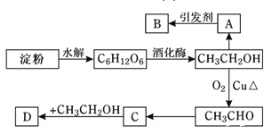
其中:A是水果催熟剂,B是高分子化合物,D是有水果香味的物质。
请回答以下问题:
(1)“C6H12O6”的结构简式是___________,C中原子团![]() 的名称是_______。
的名称是_______。
(2)写出下列转化的化学方程式及反应类型:
①A→B____________;反应类型______________。
②CH3CH2OH→CH3CHO_____________;反应类型____________。
【答案】CH2OH(CHOH)4 CHO 羧基 nCH2=CH2![]()
![]() 加聚反应 2CH3CH2OH+O2
加聚反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应
【解析】
淀粉水解生成葡萄糖,葡萄糖在酒化酶作用下分解生成乙醇,A能催熟水果,故A为乙烯,乙醇发生消去反应生成乙烯(CH2=CH2),乙烯发生加聚反应得到高分子化合物B,B为![]() ,D是有水果香味的物质,属于酯,乙醇发生氧化反应生成乙醛,C与乙醇发生酯化反应得到D,由转化关系可知C为羧酸,则C为CH3COOH,D为CH3COOCH2CH3,据此解答。
,D是有水果香味的物质,属于酯,乙醇发生氧化反应生成乙醛,C与乙醇发生酯化反应得到D,由转化关系可知C为羧酸,则C为CH3COOH,D为CH3COOCH2CH3,据此解答。
(1) C6H12O6为葡萄糖,葡萄糖为五羟基醛,结构简式为CH2OH(CHOH)4 CHO,由分析可知C为CH3COOH,C中原子团![]() 的名称是羧基,答案为:CH2OH(CHOH)4 CHO;羧基;
的名称是羧基,答案为:CH2OH(CHOH)4 CHO;羧基;
(2)① A→B是乙烯发生加聚反应得到高分子化合物聚乙烯![]() ,反应的化学方程式为:n CH2=CH2
,反应的化学方程式为:n CH2=CH2![]()
![]() ,答案为:nCH2=CH2
,答案为:nCH2=CH2![]()
![]() ;加聚反应;
;加聚反应;
②乙醇在Cu作催化剂的条件下氧化可生成乙醛,化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,属于氧化反应,答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,属于氧化反应,答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;氧化反应。
2CH3CHO+2H2O;氧化反应。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )

A. 装置②中滴入酚酞,a极附近变红B. 装置①中,一段时间后SO42﹣浓度增大
C. 用装置③精炼铜时,c极为粗铜D. 装置④中发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属有机多孔材料FJI-H14在常温常压下对CO2具有超高的吸附能力,并能高效催化CO2与环氧乙烷衍生物的反应,其工作原理如图所示。下列说法不正确的是( )
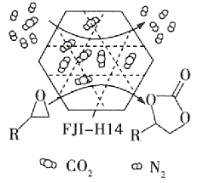
A.该材料的吸附作用具有选择性
B.该方法的广泛使用有助于减少CO2排放
C.在生成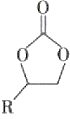 的过程中,有极性共价键形成
的过程中,有极性共价键形成
D.其工作原理只涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题

(1)A的结构简式为__________________
(2)丙烯酸中含氧官能团的名称为__________________
(3)写出反应①的反应类型:_____________
(4)写出上述框图中某些过程的化学方程式:
过程②_________________________
过程④______________________
过程⑤_________________
(5)下列有关实验的说法中正确的是_______
A. 除去乙酸乙酯中的乙酸,可加入NaOH溶液,振荡后静置分液
B. 有机物C与丙烯酸属于同系物
C. 聚丙烯酸能够使酸性高锰酸钾溶液褪色
D. 除去硝基苯中混有的少量浓HNO3和H2SO4,可将其倒入到一定量的NaOH溶液中,振荡后静置分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 可简写为
可简写为![]() 。现有某化合物W的分子结构可表示为:
。现有某化合物W的分子结构可表示为:![]() 。
。
(1)W的分子式为___________;
(2)W的一氯代物有______种。
(3)下列有关W的说法不正确的是_______(填编号)。
a. 能发生还原反应 b. 能发生氧化反应 c. 能发生加聚反应
d. 等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(4)写出W的芳香族同分异构体(能发生聚合反应)的结构简式________,该聚合反应的化学方程式为__________________________________________________。
(5)W属于_____(填编号)。
a. 芳香烃 b. 环烃 c. 不饱和烃 d. 炔烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为

A.1∶1B.5∶7C.7∶5D.4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
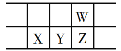
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铜(Ⅱ)酸钾[KaCub(C2O4)c·xH2O]是一种重要的化工原料。
(1)二草酸合铜(Ⅱ)酸钾晶体可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。在蒸发浓缩的初始阶段还采用了蒸馏操作,其目的是_____________________。
(2)某同学为测定草酸合铜(Ⅱ)酸钾的组成,进行如下实验:
步骤Ⅰ测定Cu2+:准确称取0.7080 g样品,用20.00 mL NH4ClNH3·H2O缓冲溶液溶解,加入指示剂,用0.1000 mol·L1的EDTA(Na2H2Y)标准溶液滴定至终点(离子方程式为Cu2++H2Y2![]() CuY2+2H+),消耗EDTA标准溶液20.00 mL;
CuY2+2H+),消耗EDTA标准溶液20.00 mL;
步骤Ⅱ测定C2O42-:准确称取0.7080 g样品,用6.00 mL浓氨水溶解,加入30.00 mL 4.0 mol·L1的硫酸,稀释至100 mL,水浴加热至70~80℃,趁热用0.1000 mol·L1 KMnO4标准液滴定至终点,消耗KMnO4溶液16.00 mL。
①已知酸性条件下MnO4-被还原为Mn2+,步骤Ⅱ发生反应的离子方程式为___________。
②步骤Ⅱ滴定终点的现象是______________________。
③通过计算确定草酸合铜(Ⅱ)酸钾的化学式(写出计算过程)。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com