
| A. | 肯定有A13+、Mg2+、NH4+、Cl- | B. | 肯定有Al3+、Mg2+、SO42- | ||
| C. | 肯定没有NH4+、HCO3-、MnO4- | D. | 肯定有Al3+、Mg2+、HCO3- |
分析 无色溶液一定不含MnO4-、Fe3+,取部分溶液,加入适量Na2O2固体,产生气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分减少,只有氢氧化铝能溶解在NaOH中,则一定含Al3+,可知不含与Al3+反应的HCO3-,白色沉淀还有氢氧化镁,则一定含Mg2+;另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,白色沉淀为硫酸钡,一定含SO42-,以此来解答.
解答 解:无色溶液一定不含MnO4-、Fe3+,取部分溶液,加入适量Na2O2固体,产生气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分减少,只有氢氧化铝能溶解在NaOH中,则一定含Al3+,可知不含与Al3+反应的HCO3-,白色沉淀还有氢氧化镁,则一定含Mg2+;另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生,白色沉淀为硫酸钡,一定含SO42-,
由上述分析可知,肯定有肯定有Al3+、Mg2+、SO42-,一定没有HCO3-、MnO4-、Fe3+,不能确定是否含NH4+、Cl-,
故选B.
点评 本题考查常见离子的检验,为高考常见题型,侧重于考查学生的分析能力和推断能力,把握离子之间的反应及现象为解答的关键,注意白色沉淀的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
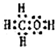 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中,不存在镁单质,碳元素多种单质 | |
| B. | CO可以还原氧化铜,Mg能还原CO2,反应类型均为置换反应 | |
| C. | 电解熔融氯化镁可制备Mg单质和氯气,海水提取海盐后的卤水可用于提取氯化镁 | |
| D. | 煤与水蒸气高温反应生成水煤气,其主要成分是CO和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氡气在标准状况下密度约是19.8g•L-1 | |
| B. | 氡气化学性质较活泼,因此对人体有害 | |
| C. | “锕射气”是氡的同位素 | |
| D. | 氡原子核外有7个电子层,最外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(OH)2悬浊液检验乙醛:向10ml10%的硫酸铜溶液中加的2%NaOH溶液4-6滴,振荡后加入乙醛溶液0.5ml,加热 | |
| B. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| C. | 向盛有过量苯酚浓溶液的试管里逐滴加入稀溴水,边加边振荡,观察三溴苯酚的生成 | |
| D. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机层的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | 25 | ① | 2.0 | 4.0 | 4.0 | t2 |
| 3 | ② | 7.0 | 2.0 | 4.0 | 2.0 | t3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com