
下列关于离子的检验方法一定正确的是
A.向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+
B.向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+
C.向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32-
D.用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+
科目:高中化学 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:实验题
(14分)过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。

实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:
假设1:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设2:反应后固体中只有 Na2SO4,证明SO2完全被氧化;
假设3: ,证明 。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂A可以选用____________________,试剂B的作用是________________________。
(3)实验测得装置C中过氧化钠质量增加了m1g,装置D质量增加了m2g,装置E中收集到的气体为VL(已换算成标准状况下),用上述有关测量数据判断SO2未被氧化、完全被氧化的V-m1关系式。
未被氧化:____________________,完全被氧化:_______________________。
(4)若SO2完全被氧化,写出 反应的化学方程式: __________________________。
反应的化学方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期期中测试化学试卷(解析版) 题型:选择题
在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O4 0.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源:2016届湖北省、宜昌一中高三上10月联考化学试卷(解析版) 题型:选择题
常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
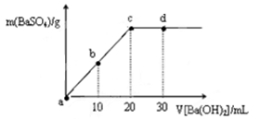
A.硫酸溶液的体积为30 mL
B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1
C.d时刻溶液的pH约为13
D.溶液的导电能力:c<d=b<a
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:选择题
将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是
A.原混合物中铜和铁各0.075 mol
B.稀硝酸的物质的量浓度为2.0 mol·L-1
C.第一次剩余4.8 g金属为铜和铁
D.向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L
查看答案和解析>>
科目:高中化学 来源:2016届广东省揭阳市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)写出反应1的离子方程式________________________, 。
(2)滤液Ⅰ中加入CaO生成的沉淀是___________,反应2的离子方程式为_____________。
(3)E可作为建筑材料,化合物C是___________,写出由D制备冰晶石的化学方程式____________。
(4)电解制铝的化学方程式是______________,以石墨为电极,阳极产生的混合气体的成分是___________。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期第一次月考化学试卷(解析版) 题型:选择题
1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(折算到标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高一上抽考化学试卷(解析版) 题型:选择题
盐是一类常见物质, 下列物质可直接形成盐的是
①金属 ②碱性氧化物 ③碱 ④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有①④⑥ C.只有②⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省宜宾市高二上学期期中测试化学试卷(解析版) 题型:选择题
下列有关实验操作中合理的是
A.用托盘天平称取11.70 g食盐
B.用量筒量取12.36 mL盐酸
C.用酸式滴定管量取21.20 mL 0.10 mol/L的H2SO4溶液
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,点在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com