
【题目】某课外活动小组在实验室用如图所示装置制取氨并验证氨的某些性质,请回答。
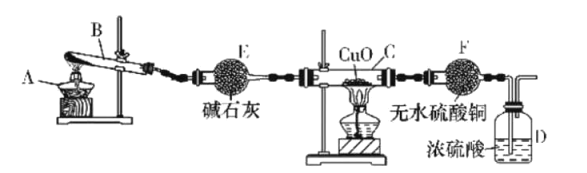
(1)写出此实验中制氨的化学方程式:___。
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,同时有氮气生成。根据这些现象,写出在硬质玻璃管内发生反应的化学方程式:__,这个反应说明氨具有___(填字母代号)。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(3)装置E的作用是__,装置F的作用是___。E中的碱石灰__(填“能”或“不能”)换成CaCl2。
(4)D中浓硫酸的主要作用是___。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 3CuO+2NH3
CaCl2+2NH3↑+2H2O 3CuO+2NH3![]() 3Cu+3H2O+N2 吸收水蒸气,干燥NH3 检验是否有水生成 不能 吸收空气中的水分,排除干扰 吸收氨,防止污染空气
3Cu+3H2O+N2 吸收水蒸气,干燥NH3 检验是否有水生成 不能 吸收空气中的水分,排除干扰 吸收氨,防止污染空气
【解析】
(1)氯化铵、氢氧化钙加热生成氨气、氯化钙、水;
(2)硬质玻璃管内黑色氧化铜粉末变为红色,说明有单质铜生成,盛无水硫酸铜的干燥管内出现蓝色,说明有水生成,同时有氮气生成。氨气中氮元素化合价由-3升高为0;
(3)碱石灰是干燥剂;无水硫酸铜遇水变蓝。CaCl2能与氨气反应;
(4)浓硫酸具有酸性,能吸收氨气,浓硫酸具有吸水性。
(1)氯化铵、氢氧化钙加热生成氨气、氯化钙、水,反应方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(2)硬质玻璃管内黑色氧化铜粉末变为红色,说明有单质铜生成,盛无水硫酸铜的干燥管内出现蓝色,说明有水生成,同时有氮气生成,氧化铜和氨气反应的方程式是3CuO+2NH3![]() 3Cu+3H2O+N2。氨气中氮元素化合价由-3升高为0,所以氨气表现还原性,选B。
3Cu+3H2O+N2。氨气中氮元素化合价由-3升高为0,所以氨气表现还原性,选B。
(3)碱石灰是干燥剂,装置E的作用是吸收水蒸气,干燥NH3;无水硫酸铜遇水变蓝,装置F的作用是检验是否有水生成。CaCl2能与氨气反应,所以E中的碱石灰不能换成CaCl2。
(4)浓硫酸具有酸性,能吸收氨气,防止污染空气;浓硫酸具有吸水性,吸收空气中的水分,防止空气中的水进入F,排除干扰。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2![]() CO2+H2O.下列有关说法正确的是( )
CO2+H2O.下列有关说法正确的是( )
A.HCHO分子中C的杂化类型为sp3杂化
B.CO2分子中的化学键为非极性键
C.HCHO分子中含σ键,又含π键
D.每生成1.8gH2O消耗2.24LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了可控结构单壁碳纳米管的制备难题。海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、锰、锌、钴等。
(1)基态铬原子的核外未成对电子数为________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为________。
(2)纳米结构氧化钴可在室温下将甲硫醛![]() 完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中
完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中![]() 键与
键与![]() 键的个数比为________。
键的个数比为________。
(3)六羰基钨![]() 的熔点为
的熔点为![]() ,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________
,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________![]() 填元素符号
填元素符号![]() 。配体CO中与W形成配位键的原子是C非O,原因是________________________。
。配体CO中与W形成配位键的原子是C非O,原因是________________________。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”。下列分子中存在“离域
键”。下列分子中存在“离域![]() 键”的有________
键”的有________![]() 填字母
填字母![]() 。
。
A.环己烷 ![]() 二氧化硫
二氧化硫 ![]() 三氟化氮
三氟化氮 ![]() 苯酚
苯酚
(5)![]() 、
、![]() 能与
能与![]() 络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
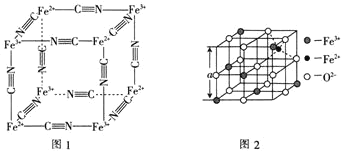
(6)图2是从铁氧体离子晶体![]() 中取出的能体现其晶体结构的一个立方体。已知
中取出的能体现其晶体结构的一个立方体。已知![]() 晶体的密度为
晶体的密度为![]() ,则图2中
,则图2中![]() ________
________![]() 已知
已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH1 =-1266 kJ/mol,P4为正四面体结构,其中P-P键的键能为198 kJ/mol,Cl-Cl键的键能为243kJ/mol。下列说法正确的是( )
A.该反应在任何温度下都能自发进行
B.1mol P4和6mol Cl2具有的总能量比4mol PCl3具有的能量低
C.P-Cl键的键能为326kJ/mol
D.PCl3的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
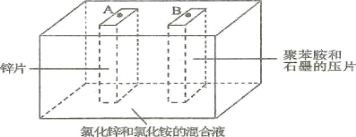
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向0.1mol/L 100mL CH3COONa的溶液中再加0.1mol CH3COONa固体后c(CH3COO-)/c(Na+)变大
B.向0.1mol/L的二元弱酸盐Na2A中不断通入HCl(g),则c(H+)/c(H2A)先变大后变小
C.已知:FeCl3(aq)+ 3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),向该平衡体系中加入固体KCl后溶液颜色变浅
3KCl(aq)+Fe(SCN)3(aq),向该平衡体系中加入固体KCl后溶液颜色变浅
D.室温时,0.1mol/L NH4HCO3溶液pH=8.1,则Ka1(H2CO3) >Kb(NH3·H2O)>Ka2(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
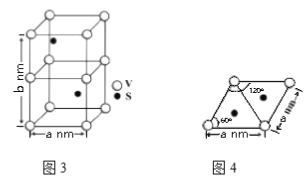
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol·L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
A. 1.2mol·L-1·min-1B. 0.02mol·L-1·min-1
C. 1.8mol·L-1·min-1D. 0.18mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2和CO可以互相转化
(1)某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | wmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%,则0-15min内平均反应速率![]() (H2)=______,此条件下该反应的平衡常数K=______。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________,且________________(用含y的等式表示)。
(H2)=______,此条件下该反应的平衡常数K=______。欲使平衡后乙与甲中相同组分气体的体积分数相等,则w、x、y、z需满足的关系是________________,且________________(用含y的等式表示)。
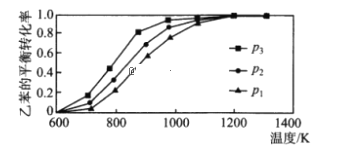
(2)研究表明,温度、压强对反应C6H5CH2CH3(g)+CO2(g) ![]() C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________。
C6H5CH=CH2(g)+CO(g)+H2O(g) ΔH中乙苯的平衡转化率影响如下图所示:则ΔH ______0(填“>”“< ” 或“=”),压强p1、p2、p3从大到小的顺序是________________。
(3)CO可被NO2氧化CO+NO2 ![]() CO2+NO。当温度高于225℃时,反应速率
CO2+NO。当温度高于225℃时,反应速率![]() 正=k正·c(CO) ·c(NO2)、
正=k正·c(CO) ·c(NO2)、![]() 逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______。
逆= k逆·c(CO2) ·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com