
分析 (1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)氯气具有氧化性能氧化氯化亚铁为氯化铁;
(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响;
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子的检验特征反应现象,第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,随浓度变小,碘离子在稀的氯化铁溶液中不发生氧化还原反应;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子;
解答 解:(1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化,
故答案为:防止氯化亚铁被氧化;
(2)氯气具有氧化性能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(3)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响,
故答案为:隔离空气(排除氧气对实验的影响);
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子的检验特征反应现象,实验②检验的离子是Fe2+,①第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,③第三支试管中加入1滴KSCN溶液,溶液变红,说明随浓度变小,碘离子在稀的氯化铁溶液中不发生氧化还原反应,仍含有铁离子,在I-过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应,
故答案为:Fe2+;Fe3+;可逆反应;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评 本题考查了铁架化合物性质、主要是溶液配制、离子方程式书写、离子检验、盐类水解等知识点,注意题干信息的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
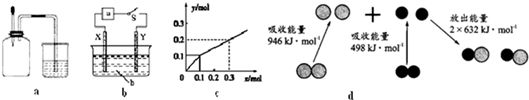
| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-180 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
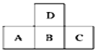
| A. | 只有A的单质存在同素异形体 | |
| B. | D的最高正价与B的最高正价相等 | |
| C. | A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C>B>A | |
| D. | 原子半径的大小顺序是C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成3n mol X,同时消耗n mol Y | |
| B. | X的生成速率与Z的消耗速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的物质的量之比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | 反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O | |
| C. | 当x=1时,每生成2.5mol N2,被氧化的气体有3mol | |
| D. | 当x=2时,有1mol气体被还原时,转移的电子为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | NO2和N2O4平衡混合气缩小体积加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 煅烧硫铁矿利于SO2的生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com