
”¾ĢāÄæ”æij»ÆѧŠĖȤŠ”×éĪŖĮĖĢ½¾æĢ¼ĖįøĘÓėĻ”ŃĪĖį·“Ó¦¹ż³ĢÖŠµÄĖŁĀŹ±ä»Æ£¬ŌŚVmLĻ”ŃĪĖįÖŠ¼ÓČė×ćĮæµÄĢ¼ĖįøĘ£¬ŹÕ¼Æ·“Ó¦·Å³öµÄCO2£ØĘųĢåĢå»żŅŃ»»ĖćĪŖ±ź×¼×“æöĻĀµÄŹżÖµ£©£¬ŹµŃé¼ĒĀ¼ČēĻĀ£ØĄŪ¼ĘÖµ£©£ŗ
Ź±¼ä£Ømin£© | 1 | 2 | 3 | 4 | 5 |
CO2Ģå»ż£ØmL£© | 50 | 120 | 232 | 290 | 310 |
£Ø1£©0”«1 min”¢1”«2 min”¢2”«3 min”¢3”«4 min”¢4”«5 minĪåøöŹ±¼ä¶ĪÖŠ£¬_________·“Ó¦ĖŁĀŹ×īæģ”£
£Ø2£©¼ŁÉčČÜŅŗĢå»ż²»±ä£¬4”«5minŹ±¼ä¶ĪŅŌŃĪĖįµÄÅØ¶Č±ä»ÆĄ“±ķŹ¾µÄøĆ·“Ó¦ĖŁĀŹĪŖ____________________________”£
£Ø3£©ĪŖĮĖ½µµĶÉĻŹö»Æѧ·“Ó¦µÄ·“Ó¦ĖŁĀŹ£¬ĻņČÜŅŗÖŠ¼ÓČėĻĀĮŠĪļÖŹ£¬ÄćČĻĪŖæÉŠŠµÄŹĒ
_______________£ØĢī±ąŗÅ£©”£
a£®ÕōĮóĖ® b£®ÅØŃĪĖį c£®NaCl¹ĢĢå d£®NaClČÜŅŗ
£Ø4£©³żĮĖÉĻŹö·½·ØĶā£¬ÄćČĻĪŖ»¹æÉŅŌ²ÉČ”ÄÄŠ©“ėŹ©Ą“½µµĶ»Æѧ·“Ó¦ĖŁĀŹ£æ£ØŹŌŠ“Į½Ģõ£©_______________________________________________________________________£¬
________________________________________________________________________ӣ
”¾“š°ø”æ 2”«3 min 1/560v mol”¤L-1”¤min-1 a”¢d ½µµĶ·“Ó¦ĪĀ¶Č ¼õÉŁ½Ó“„Ć껿
”¾½āĪö”æÓɱķøńŹż¾ŻæÉÖŖ£¬0”«1”¢1”«2”¢2”«3”¢3”«4”¢4”«5minÉś³ÉĒāĘų·Ö±šĪŖ50mL”¢70mL”¢112mL”¢58mL”¢20mL”£
(1)2 min”«3 minŹÕ¼ÆµÄĒāĘų±ČĘäĖūŹ±¼ä¶Ī¶ą£¬Ōņ·“Ó¦ĖŁĀŹ×ī“ó£¬ÓėøĆ·“Ó¦·ÅČČ£¬ĪĀ¶ČÉżøß¼Óæģ·“Ó¦ĖŁĀŹÓŠ¹Ų£¬¹Ź“š°øĪŖ£ŗ2”«3 min£»
(2)ŌŚ4”«5minŹ±¼ä¶ĪÄŚ£¬Éś³É±źæöĻĀ¶žŃõ»ÆĢ¼µÄĢå»żĪŖ£ŗ20mL£¬n(CO2)= ![]() =
= ![]() mol£¬ÓÉ2HCl”«CO2æÉÖŖ£ŗĻūŗÄŃĪĖįµÄĪļÖŹµÄĮæĪŖ
mol£¬ÓÉ2HCl”«CO2æÉÖŖ£ŗĻūŗÄŃĪĖįµÄĪļÖŹµÄĮæĪŖ![]() mol£¬Ōņ¦Ō(HCl)=
mol£¬Ōņ¦Ō(HCl)= 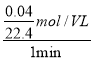 =
=![]() mol/(Lmin)£¬¹Ź“š°øĪŖ£ŗ
mol/(Lmin)£¬¹Ź“š°øĪŖ£ŗ ![]() mol/(Lmin)£»
mol/(Lmin)£»
(3)a£®¼ÓČėÕōĮóĖ®£¬ŃĪĖįµÄÅØ¶Č¼õŠ”£¬·“Ó¦ĖŁĀŹ¼õĀż£¬ÕżČ·£»b£®¼ÓČėÅØŃĪĖį£¬ŃĪĖįµÄÅضČŌö“󣬷“Ó¦ĖŁĀŹ¼Óæģ£¬“ķĪó£»c£®¼ÓČėNaCl¹ĢĢ壬ŃĪĖįµÄÅØ¶Č²»±ä£¬·“Ó¦ĖŁĀŹ²»±ä£¬“ķĪó£»d£®NaClČÜŅŗ £¬Ļąµ±ÓŚĻ”ŹĶŃĪĖį£¬ŃĪĖįµÄÅØ¶Č¼õŠ”£¬·“Ó¦ĖŁĀŹ¼õĀż£¬ÕżČ·£»¹ŹŃ”ad£»
(4)ŅŖ½µµĶĢ¼ĖįøĘŗĶŃĪĖįµÄ»Æѧ·“Ó¦ĖŁĀŹ£¬æÉŅŌøł¾ŻÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲæ¼ĀĒ£¬Čē½µµĶ·“Ó¦ĪĀ¶Č”¢¼õÉŁ½Ó“„Ć껿µČ£¬¹Ź“š°øĪŖ£ŗ½µµĶ·“Ó¦ĪĀ¶Č”¢¼õÉŁ½Ó“„Ć껿”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ŅŃÖŖ£ŗ¢Ł2Fe£Øs£©+O2£Øg£©=2 FeO£Øs£©”÷H1=©544.0kJmol©1£»
¢Ś4Al£Øs£©+3O2£Øg£©ØT2Al2O3£Øs£©”÷H2=©3351.4kJmol©1”£
AlŗĶFeO·¢ÉśĀĮČČ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ŹĒ
£Ø2£©·“Ó¦ĪļÓėÉś³ÉĪļ¾łĪŖĘųĢ¬µÄijæÉÄę·“Ó¦ŌŚ²»Ķ¬Ģõ¼žĻĀµÄ·“Ó¦Ąś³Ģ·Ö±šĪŖA”¢B£¬ČēĶ¼ĖłŹ¾”£
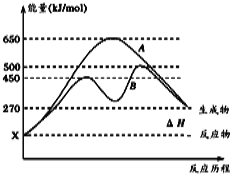
¢Ł¾ŻĶ¼ÅŠ¶ĻøĆ·“Ó¦ŹĒ £ØĢī”°Īü”±»ņ”°·Å”±£©ČČ·“Ó¦£¬µ±·“Ó¦“ļµ½Ę½ŗāŗó£¬ĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Äę·“Ó¦ĖŁĀŹ½« £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
¢ŚĘäÖŠBĄś³Ģ±ķĆ÷“Ė·“Ó¦²ÉÓƵÄĢõ¼žĪŖ £ØĢī×ÖÄø£©”£
A£®ÉżøßĪĀ¶Č B£®Ōö“ó·“Ó¦ĪļµÄÅضČ
C£®½µµĶĪĀ¶Č D£®Ź¹ÓĆ“ß»Æ¼Į
£Ø3£©ŅŃÖŖČČ»Æѧ·½³ĢŹ½£ŗ2H2£Øg£©+O2£Øg£©=2H2O£Øg£©”÷H=©483.6kJmol©1£¬øĆ·“Ó¦µÄ»ī»ÆÄÜĪŖ334.4kJmol©1£¬ŌņĘäÄę·“Ó¦µÄ»ī»ÆÄÜĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞Ńõ»Æīę(CeO2)ŹĒŅ»ÖÖÖŲŅŖµÄĻ”ĶĮŃõ»ÆĪļ£¬Ę½°åµēŹÓĻŌŹ¾ĘĮÉś²ś¹ż³ĢÖŠ²śÉś“óĮæµÄ·Ļ²£Į§·ŪÄ©£Øŗ¬SiO2”¢Fe2O3”¢CeO2”¢FeOµČĪļÖŹ£©”£Ä³æĪĢā×éŅŌ“Ė·ŪÄ©ĪŖŌĮĻ£¬Éč¼ĘČēĻĀ¹¤ŅÕĮ÷³Ģ¶Ō׏Ō“½ųŠŠ»ŲŹÕ£¬µĆµ½“æ¾»µÄCeO2ŗĶĮņĖįĢśļ§¾§Ģ唣
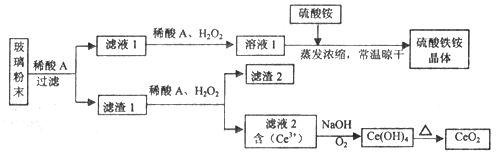
ŅŃÖŖ£ŗCeO2²»ČÜÓŚĻ”ĮņĖį£¬Ņ²²»ČÜÓŚNaOHČÜŅŗ”£
(1)Ļ”ĖįAµÄ·Ö×ÓŹ½ŹĒ_____________________”£
(2)ĀĖŅŗ1ÖŠ¼ÓČėH2O2ČÜŅŗµÄÄæµÄŹĒ__________________”£
(3)Éč¼ĘŹµŃéÖ¤Ć÷ĀĖŅŗ1ÖŠŗ¬ÓŠFe2+_____________________”£
(4)ŅŃÖŖFe2+ČÜŅŗæÉŅŌŗĶÄŃČÜÓŚĖ®µÄFeO(OH)·“Ӧɜ³ÉFe3O4,ŹéŠ“øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½____________”£
(5)ÓÉĀĖŅŗ2Éś³ÉCe(OH)4µÄĄė×Ó·½³ĢŹ½__________________”£
(6)ĮņĖįĢśļ§¾§Ģå[Fe2(SO4)3”¤2(NH4)2SO4”¤3H2O]¹ć·ŗÓĆÓŚĖ®µÄ¾»»Æ“¦Ąķ£¬µ«ĘäŌŚČ„³żĖįŠŌ·ĻĖ®ÖŠµÄŠüø”ĪļŹ±Š§ĀŹ½µµĶ£¬ĘäŌŅņŹĒ___________________”£
(7)Č”ÉĻŹöĮ÷³ĢÖŠµĆµ½µÄCe(OH)4²śĘ·0.531 g£¬¼ÓĮņĖįČܽāŗó£¬ÓĆÅضČĪŖ0.l000mol”¤L-1FeSO 4±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµćŹ±£Øīę±»»¹ŌĪŖCe3+ )£¬ĻūŗÄ25.00 mL±ź×¼ČÜŅŗ”£øĆ²śĘ·ÖŠCe(OH)4µÄÖŹÖĆ·ÖŹżĪŖ_______(½į¹ū±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµ±¹āŹųĶعżĻĀĮŠĪļÖŹ£ŗ¢Ł³¾°£µÄæÕĘų ¢ŚĒāŃõ»ÆÄĘČÜŅŗ ¢ŪÕōĮóĖ® ¢Üµķ·ŪČÜŅŗ£¬ÄܹŪ²ģµ½ÓŠ¶”“ļ¶ūĻÖĻóµÄŹĒ
A. ¢Ł¢Ś B. ¢Ś¢Ū C. ¢Ł¢Ü D. ¢Ś¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉś²ś”¢Éś»īÖŠ³£Éč¼Ę»ÆѧÖŖŹ¶£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ”°ŗ£ŹŠņ×Ā„”±ĻÖĻóŹĒ½ŗĢåµÄ¶”“ļ¶ūŠ§Ó¦Ōģ³ÉµÄ
B. Ć÷·ÆæÉÓĆÓŚŌŁĄ“Ė®µÄ¾»»ÆŗĶĻū¶¾
C. ŌŚĻć½¶ĻäÖŠ·ÅČė½žÓŠKMnO4ČÜŅŗµÄ¹čŌåĶĮæÉŃÓ³¤±£ĻŹĘŚ
D. ÓÉÓŚµāµ„ÖŹŹÜČČŅ×Éż»Ŗ£¬ĖłŅŌ³“²ĖŹ±¼ÓµāŃĪ×īŗó·Å
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢E”¢FĮłÖÖ¶ĢÖÜĘŚŌŖĖŲ·Ö±šĪ»ÓŚČżøöÖÜĘŚ£¬ĖüĆĒµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£AÓėDĶ¬Ö÷×壬BÓėEĶ¬Ö÷×壬CÓėFĶ¬Ö÷×壬ĒŅCÓėFÄÜŠĪ³ÉŌ×ÓøöŹż±ČĪŖ2”Ć1µÄ»ÆŗĻĪļMÓėŌ×ÓøöŹż±ČĪŖ3”Ć1µÄ»ÆŗĻĪļN”£ŅŃÖŖFµÄµ„ÖŹĪŖµ»ĘÉ«¹ĢĢ壬EŌŖĖŲŌŚµŲæĒÖŠŗ¬Įæ¾ÓµŚ2Ī»£¬DĪŖ½šŹō”£
(1)Š“³öĻĀĮŠŌŖĖŲ·ūŗÅ£ŗA________£¬B________£¬E__________”£
(2)ÉŁĮæMÓėDµÄ×īøß¼ŪŃõ»ÆĪļĖ®»ÆĪļ·“Ó¦µÄ»Æѧ·½³ĢŹ½____________________________”£
(3)Š“³öFŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆ________________”£
(4)Š“³öA”¢C”¢DŠĪ³ÉµÄ»ÆŗĻĪļµÄµē×ÓŹ½___________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖÄÖÖ»ł±¾ĄąŠĶ·“Ó¦ÖŠŅ»¶ØŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄŹĒ£Ø £©
A.ø“·Ö½ā·“Ó¦
B.·Ö½ā·“Ó¦
C.»ÆŗĻ·“Ó¦
D.ÖĆ»»·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æI.ĻĀĮŠĮ½ÖÖČÜŅŗÖŠ£¬ŹŅĪĀĻĀÓÉĖ®µēĄėÉś³ÉµÄH£«ÅضČÖ®±Č(¢Ł”Ć¢Ś)ŹĒ ”£
¢ŁpH£½1µÄŃĪĖį ¢Ś0.01 mol”¤L£1µÄNaOHČÜŅŗ
II.ŅŃÖŖĖ®ŌŚ25”ęŗĶ95”ꏱ£¬ĘäµēĄėĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾£ŗ
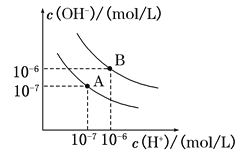
£Ø1£©Ōņ25”ꏱĖ®µÄµēĄėĘ½ŗāĒśĻßÓ¦ĪŖ (Ģī”°A”±»ņ”°B”±)£»95”ꏱĖ®µÄĄė×Ó»żKW= ”£
£Ø2£©25”ꏱ£¬½«pH£½9µÄBa(OH)2ČÜŅŗÓėpH£½4µÄH2SO4ČÜŅŗ»ģŗĻ£¬ČōĖłµĆ»ģŗĻČÜŅŗµÄpH£½7£¬ŌņBa(OH)2ČÜŅŗÓėH2SO4ČÜŅŗµÄĢå»ż±ČĪŖ ”£
£Ø3£©ĒśĻßA¶ŌÓ¦ĪĀ¶ČĻĀ£¬pH£½2µÄŃĪĖįČÜŅŗŗĶpH£½11µÄĒāŃõ»ÆÄĘČÜŅŗ°“Ģå»ż±Č1:9»ģŗĻ£¬ČÜŅŗµÄpHŌ¼ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»ĆܱÕČŻĘ÷ÖŠĶØČėA”¢B”¢CČżÖÖĘųĢ壬±£³ÖŅ»¶ØĪĀ¶Č£¬ŌŚt1”«t4 sŹ±²āµĆø÷ĪļÖŹµÄÅضČČē±ķ£¬ŌņĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ( )
²ā¶ØŹ±æĢ/s ÅØ¶Č | t1 | t2 | t3 | t4 |
c(A)/(mol”¤L£1) | 6 | 3 | 2 | 2 |
c(B)/(mol”¤L£1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol”¤L£1) | 1 | 2.5 | 3 | 3 |
A. ŌŚt3 sŹ±·“Ó¦ŅŃ¾Ķ£Ö¹
B. t3”«t4 sÄŚÕż”¢Äę·“Ó¦ĖŁĀŹ²»ĻąµČ
C. ŌŚČŻĘ÷ÖŠ·¢ÉśµÄ·“Ó¦ĪŖA(g)£«B(g) C(g)
D. ŌŚt2”«t3 sÄŚAµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ![]() mol/(L”¤s)
mol/(L”¤s)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com