
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
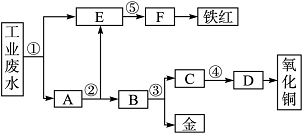
填写下面空白。
(1)图中标号处需加入的相应物质分别是①________,②________,③________,④________,⑤________(填化学式名称)。
(2)写出①处发生反应的离子方程式________________________________________________________________________;
写出③处发生反应的化学方程式________________________________________________________________________。
(3)铁红的化学式为________。
(4)分别写出铁红和氧化铜在工业上的一种主要用途:铁红________ ______________________________
______________________________ ________________________;
________________________;
氧化铜_____________________________________________________。
答案 (1)①废铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠(或氨水)
②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠(或氨水)
(2)Fe+2H+===Fe2++H2↑;2Fe3++Fe===3Fe2+;
Cu2++Fe===Cu+Fe2+;2Au3++3Fe===2Au+3Fe2+
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2 O
O
(3)Fe2O3
(4)用做红色涂料 用做制造铜盐的原料
解析 本题主要考查了元素与化合物的有关知识。题目通过对工业废水的处理,考查了高中重要的金属Fe、Cu的有关性质,涉及内容主要有物质推断、离子方程式书写、物质用途等。在解此题时宜采用逆向推断法,从题中给出信息可知,首先分离的应是铁元素,所加最佳试剂应是废铁屑,E溶液就为Fe2+,铁红成分为Fe2O3,可联想到高中重要反应2Fe(OH)3 Fe2O3+3H2O,试剂⑤应为可溶性碱(NaOH或氨水);当加入过量铁粉后,所得A应为固体Fe、Cu、Au的混合物,此时,只需加入稀硫酸(试剂②)后过滤可得Cu、Au混合物B,再加入稀硝酸(试剂③)可使Cu、Au得到分离,Cu(NO3)2加可溶性碱(④NaOH)后加热得到CuO。
Fe2O3+3H2O,试剂⑤应为可溶性碱(NaOH或氨水);当加入过量铁粉后,所得A应为固体Fe、Cu、Au的混合物,此时,只需加入稀硫酸(试剂②)后过滤可得Cu、Au混合物B,再加入稀硝酸(试剂③)可使Cu、Au得到分离,Cu(NO3)2加可溶性碱(④NaOH)后加热得到CuO。


科目:高中化学 来源: 题型:
由乙烯推测丙烯(CH2=CH-CH3)与溴水反应时,反应产物是( )
A.CH2Br—CH2—CH2Br B.CH3-CBr2-CH3
C.CH3-CH2-CHBr2 D.CH3—CHBr—CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A.同系物之间在化学性质上相似
B.同系物不可能是同分异构体
C.同系物之间的物理性质随分子里碳原子数的递增,呈规律性的变化
D.分子组成相差一个或几个CH2原子团的物质互称为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是________,只有还原性的是________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
其中你认为一定不可能实现的是________。
(3)下列三个氧化还原反应中,氧化性最强的物质是______。
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的________作氧化剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+
C.Fe2+ D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氯气、氯水的叙述中,下列正确的是 ( )
A.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
B.新制氯水可以使干燥的有色布条褪色
C.新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水在光照下,可以产生气体,该气体是氧气,所得溶液酸性、氧化性均减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
关于硝酸、浓硫酸的说法正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸具有吸水性可用作干燥剂,能够干燥氨气、氢气等气体
C. Zn、Fe等金属与硝酸反应制取H2
D.浓硝酸、浓硫酸在常温下能够使铁、铝等金属形成致密氧化膜而钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
4.6g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到4480mLNO2和336 mLN2O4 的混合气体(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是46:69
B.该浓硝酸中HNO3的物质的量浓度是14.0mol·L-1
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com