
| A. | Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-=H2O 2KOH+H2SO4═K2SO4+2H2O |
分析 A.碳酸铜为沉淀,不能拆;
B.碳酸钡为沉淀,不能拆;
C.Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3反应实质钙离子与碳酸根离子生成碳酸钙沉淀;
D.2KOH+H2SO4═K2SO4+2H2O反应的实质是氢离子与氢氧根离子反应生成水.
解答 解:A.CuCO3+2NaOH═Cu(OH)2↓+Na2CO3,反应的离子方程式:CuCO3+2OH-═Cu(OH)2+2Na++CO32-,不能用离子方程式Cu2++2OH-=Cu(OH)2↓表示,故A错误;
B.BaCO3+2HCl═BaCl2+CO2↑+H2O,离子方程式:BaCO3+2H+═Ba2++CO2↑+H2O,不能用 CO32-+2H+=CO2↑+H2O,故B错误;
C.Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3反应实质钙离子与碳酸根离子生成碳酸钙沉淀,离子方程式:Ca2++CO32-=CaCO3↓,故C错误;
D.2KOH+H2SO4═K2SO4+2H2O反应的实质是氢离子与氢氧根离子反应生成水,离子方程式:H++OH-=H2O,故D正确;
故选:CD.
点评 本题考查了离子方程式的书写,明确反应的实质是解题关键,注意离子方程式书写应符合客观规律、应遵循原子个数、电荷数守恒,注意化学式的拆分.


科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| B. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| C. | 为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,该方案可行 | |
| D. | 为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出,洗涤,烘干,称重.若烘干时间过长,会导致测定结果偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
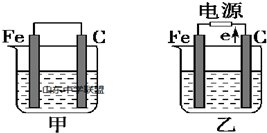
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以地沟油为原料加工制成的生物柴油的成分与从石油分馏得到的柴油成分不同 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学平衡原理是中学化学学习的重要内容.请回答下列问题:
化学平衡原理是中学化学学习的重要内容.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: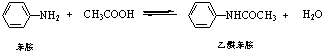
| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Zn2++2e-═Zn | B. | Cu2++2e-═Cu | C. | Zn-2e-═Zn2+ | D. | 2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钡可用于治疗胃酸过多的药 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | 碳纤维是复合材料 | |
| D. | PM2.5指数是雾霾天气监测中的重要指标 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com