
I.下表为周期表的一部分,其中的编号代表对应的元素。

(1)写出上表中元素I的价层电子排布图 。元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有( )
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)的配位化合物,该物质常温下呈液态,熔点为一20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断:该化合物的晶体中存在的作用力有( )
A.离子键
B.极性键
C.非极性键
D.范德华力
E.氢键
F.配位键
Ⅱ.(1) BCl3中B原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有 种。写出与BCl3结构相同的一种等电子体 (写离子)。
(2)科学家测得胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
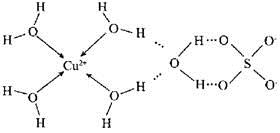
①胆矾的化学式用配合物的形式表示为的 ;
②胆矾中SO42-的空间构型为 。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2015-2016学年江西省南昌市八一、洪都等五校高一下期末化学试卷(解析版) 题型:选择题
已知汽车尾气无害化处理反应为:2NO(g)+2CO (g) 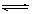 N2(g)+2CO2(g)。下列说法错误的是( )
N2(g)+2CO2(g)。下列说法错误的是( )
A.通入大量NO,ν(正)、ν(逆)均增大
B.恒温恒容下充入Ne,ν(正)、ν(逆)均不变
C.ν正(NO) =2ν逆(N2)时,反应达到平衡
D.n (NO)∶n (CO)∶n (N2)∶n (CO2) =2∶2∶1∶2时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高一5月月考化学试卷(解析版) 题型:选择题
下列物质中属于有机物的是
①乙醇 ②食盐 ③石墨 ④甲烷 ⑤蔗糖 ⑥水 ⑦一氧化碳 ⑧碳酸钙 ⑨乙酸
A.①②④⑤⑨ B.①④⑤⑨ C.①③④⑤⑦⑧⑨ D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省遂宁市高一6月月考化学试卷(解析版) 题型:选择题
下列各组物质不属于同系物的是
A.CH4和CH3(CH2)15CH3
B.C2H4和CH3CH2CH3
C.CH3(CH2)3CH3和CH(CH3)3
D.C3H8和CH3(CH2)6CH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省遂宁市高一6月月考化学试卷(解析版) 题型:选择题
有关 的说法不正确的是( )
的说法不正确的是( )
A. 质量数为19 B. 中子数为7 C. 电子数为6 D. 质子数为6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如右图所示的实验,发现烧杯中溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是( )
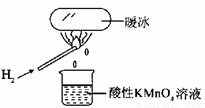
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20~C时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
在浓盐酸中HNO2与SnCl2反应的离子方程式为
3SnCl2+12Cl-+2HNO2+6H+═N2+3SnClxy-+4H2O.关于该反应的说法都正确的是( )
①氧化剂是HNO2;②还原性:Cl->N2;③每生成2.8g N2,还原剂失去的电子为0.6mol;④x为4,y为2;⑤SnClxy-是氧化产物;
A.①③⑤ B.①③④⑤ C.①②③④ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:填空题
硝酸铝是一种常见常见媒染剂。工业上用含铝废料(主要含Al、Al2O3、Fe3O4、SiO2等)制取硝酸铝晶体[Al(NO3)3·9H2O]及铝单质的流程如下:

(1)写出反应Ⅰ中Fe3O4参加反应的离子方程式: 。
(2)写出反应Ⅱ的离子方程式: 。
(3)该流程中有一处设计不合理,请指出并加以改正: 。
(4)写出反应Ⅵ的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下学期期中考试化学试卷(解析版) 题型:填空题
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
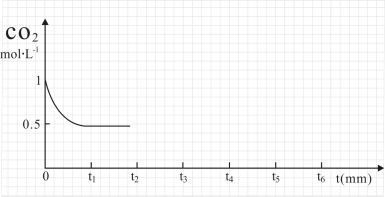
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
(2)改变温度,使反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6[ | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com