
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
分析 若要使溶液的橙色加深,则加入的物质能使平衡向正反应方向移动,注意K2Cr2O7是一种比高锰酸钾还要强的氧化剂,可以氧化氯离子,结合平衡移动原理分析解答.
解答 解:A.加水稀释溶液,促进Cr2O72-水解,所以平衡向逆反应方向移动,橙色变浅,故A错误;
B.加入适量稀硫酸,氢离子浓度增大,平衡向正反应方向移动,溶液橙色加深,故B正确;
C.加入适量烧碱固体,烧碱和氢离子反应使平衡向逆反应方向移动,橙色变浅,故C错误;
D.加Na2SO4(s),氢离子的浓度不变,所以平衡不移动,故D错误;
故选B.
点评 本题考查化学平衡移动的影响因素,易错选项是A,注意Cr2O72-能氧化氯离子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
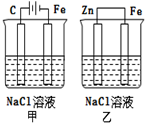
| A. | 甲装置是牺牲阳极的阴极保护法 | |
| B. | 乙装置是牺牲阳极的阴极保护法 | |
| C. | 一段时间后甲、乙装置中pH均增大 | |
| D. | 甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B是固体和C是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 乙烯可作为水果的催熟剂 | |
| C. | 葡萄糖、油脂、蛋白质等进入人体内经水解后被吸收 | |
| D. | 使用漂白液时不可与酸性洁厕剂混用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:
氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
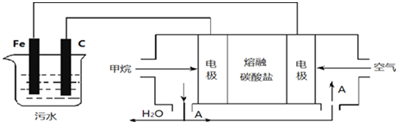
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、Cl-、H+ | B. | Fe2+、SO42-、CO32-、NO3- | ||
| C. | Ba2+、NO3-、Cl-、Na+ | D. | K+、NH4+、SO42-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com