
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
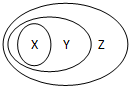 用图表示的一些物质或概念间的从属关系中正确的是( )
用图表示的一些物质或概念间的从属关系中正确的是( )| X | Y | Z | |
| A | 铜 | 单质 | 非电解质 |
| B | 氯化钠溶液 | 导电的物质 | 电解质 |
| C | 氢氧化钠 | 碱类 | 电解质 |
| D | 氯化氢 | 不导电的物质 | 非电解质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ①2由C、H、O三种元素组成; ②球棍模型为: 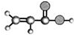 ; ;③能与NH3在一定条件下反应生成丙烯酰胺CH2=CHCONH2; ④能使溴水褪色. |
| B | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与A反应生成相对分子质量为100的酯. |
| C | ①密度是相同条件下氢气密度的30倍; ②能与NaHCO3溶液反应放出CO2气体 |
| D | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成B; ③属于石油裂解气的成份之一. |
| E | ①2由C、H两种元素组成; ②分子球棍模型为: 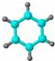 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Na+) |
| c(HCO3-) |
| A、①④ | B、②⑤ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数编号 | 盐酸溶液体积 V(mL) | 氢氧化钠溶液 体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com