
| A. | 该物质既能与强酸反应又能与强碱反应 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1 mol[NaAl(OH)2CO3]最多可消耗4 mol H+ | |
| D. | 该药剂不适合于胃溃疡患者服用 |
分析 A.该物质是碱式复盐,具有氢氧化铝、碳酸钠的性质;
B.双羟基铝碳酸钠是一种盐;
C.羟基(实际为氢氧根)与碳酸根能盐酸反应;
D.该物质与较多的H+反应会产生二氧化碳和水.
解答 解:A.该物质是碱式复盐,具有氢氧化铝、碳酸钠的性质,所以既能与强酸反应又能与强碱反应,故A正确;
B.NaAl(OH)2CO3属于纯净物,不是混合物,故B错误;
C.NaAl(OH)2CO3和酸发生反应:NaAl(OH)2CO3+4HCl=NaCl+AlCl3+3H2O+CO2↑,1molNaAl(OH)2CO3最多可消耗4molH+,故C正确;
D.NaAl(OH)2CO3能与盐酸反应,所以能治疗胃酸过多的胃病患者,但胃溃疡患者不能服用此物,因为产生的CO2对胃有刺激作用,胃溃疡患者会加重,故D正确.
故选:B.
点评 本题考查碱和盐的概念,可以根据NaAl(OH)2CO3含有的阴离子,用混合物氢氧化铝、碳酸钠的性质理解其性质,但注意实际为一种盐.


科目:高中化学 来源: 题型:解答题
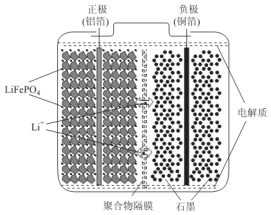
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
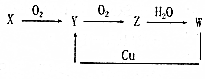 已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )
已知X、Y、Z、W均为四种常见物质,且它们之间有如下转化关系,下列说法正确的是( )| A. | X、Y、Z、W均为含有同种元素的化合物 | |
| B. | 若X能与Y反应,则X、Y-定是H2S和SO2 | |
| C. | Z→W的反应一定是氧化还原反应 | |
| D. | 在W的稀溶液滴入石蕊试剂都显红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | HC1O具有漂白性 | 湿润的Cl2能使有色布条褪色 |
| B | SiO2具有导电性 | SiO2可用于制光导纤维 |
| C | 铝的金属性比铁强 | 铝制品在空气中比铁制品更容易腐蚀 |
| D | 碳酸钠属于碱类 | 工业上的“三酸二碱”,把碳酸钠归纳为“碱” |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 元素性质或原子结构 |
| X | X的某一种原子没有中子 |
| Y | 最高正价与最低负价的代数和为0 |
| Z | 最外层电子数是周期数的3倍 |
| M | 含M元素的物质,其焰色反应为黄色 |
| G | G的简单离子半径在同周期中最小 |
| A. | X是组成有机物的必需元素 | |
| B. | Y、Z所形成的氢化物分子均含有10个电子 | |
| C. | Z的简单离子半径大于G的简单离子半径 | |
| D. | G的氧化物不溶于M的最高价氧化物所对应的水化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | 该反应属于离子反应 | |
| C. | 若有0.1mol氯气参与反应,则转移电子0.1mol | |
| D. | 该反应中Cl2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力越弱,分子晶体的熔点越低 | |
| B. | 氯化铵受热分解,断裂离子键和共价键 | |
| C. | 金刚石、C60都不存在独立的小分子 | |
| D. | 断裂化学键,需要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 燃料电池工作时,正极反应为O2+2H2O+4e-═4OH- | |
| B. | 此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com