
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
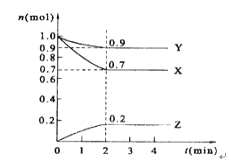
(1)X的转化率是_______;
(2)由图中所给数据进行分析,该反应的化学方程式为_______________;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=__________;
(4)当反应进行到第___min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为______。
【答案】30%3X+Y![]() 2Z0.05mol/(L·min)250%
2Z0.05mol/(L·min)250%
【解析】
(1)由图象可以看X的转化率=变化量/初始量×100%=[(1.0-0.7)mol/1.0mol] ×100%=30%。因此答案是:30%。
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y2Z。因此,本题答案是:3X+Y2Z;
(3)由图象可以看出v(Z)=0.2mol/(2L![]() 2min)=0.05mol(Lmin)-1,因此,答案是:0.05mol(Lmin)-1。
2min)=0.05mol(Lmin)-1,因此,答案是:0.05mol(Lmin)-1。
(4)由图象可以看出当反应进行到2min时,达到平衡状态,各组分的浓度不随时间的变化而变化。根据阿伏伽德罗定律,若三种物质都是气体,平衡时Y所占体积的百分比=0.9mol/(0.7+0,2+0.9)×100%=50%,因此,本题答案是:2、50%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
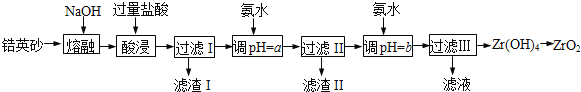
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为___________________________________________,滤渣I的化学式为___________________
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是____________________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为:________________________________________
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:____________________________
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:___SiO2 + C + N2![]() Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。__________
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________(填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为2H2O+2e-===2OH-+H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+ O2![]() 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3![]() MnO+ CO2;②2MnO +O2
MnO+ CO2;②2MnO +O2![]() 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,碳酸锰热分解反应的平衡常数K=________(分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2的关系为_________________。
(2)反应②在低温下能自发进行,则其△H__________0 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变。请回答:
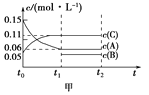
(1)写出该反应的化学方程式________________________________________;
(2)若t1=15 s,则用B的浓度变化表示的t0~t1阶段的平均反应速率为_____________;
(3)反应起始时B的体积分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化苄(C6H5CH2Cl)为无色液体,是一种重要的有机化工原料。现在实验室模拟工业上用甲苯与干燥氯气在光照条件下加热反应合成氯化苄、分离出氯化苄并检验样品的纯度,其装置(夹持装置略去)如图所示:

回答下列问题:
(1)仪器E的名称是_____________;其作用是_______________________________________。
(2)装置B中的溶液为___________________。
(3)用恒压滴液漏斗代替分液漏斗的优点是__________________________________________。
(4)装置A中反应的离子方程式为__________________________________________________。
(5)反应结束后,关闭K1和K2,打开K3,加热三颈烧瓶,分馏出氯化苄,应选择温度范围为______℃。
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
(6)检测氯化苄样品的纯度:
①称取13.00g样品于烧杯中,加入50.00mL 4 molL-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3,再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为_____%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。

(1)关于该反应的下列说法中,正确的是_______;
A.△H>0,△S>0; B.△H>0,△S<0; C.△H<0,△S<0; D.△H<0,△S>0。
(2)该图中能量的最高点和最低点之间的差值代表___________;
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com