
分析 (1)硫氰酸根离子与三价铁离子反应生成硫氰合铁络合物;
(2)铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀;
(3)高锰酸钾具有强的氧化性,能够氧化草酸根离子;
(4)硫代硫酸在酸性环境下发生歧化反应生成硫沉淀和二氧化硫;
(5)碳酸根为多元弱酸根离子,分步水解,以第一步水解为主,水解生成碳酸氢根离子和氢氧根离子;
解答 (1)三价铁离子与硫氰根离子发生络合反应生成硫氰合铁络合物,离子方程式;Fe3++3SCN-=Fe(SCN)3;
故答案为:Fe3++3SCN-=Fe(SCN)3;
(2)铁氰化酸根离子与二价铁离子生成铁氰化亚铁沉淀,离子方程式:3Fe2++2[Fe(CN)6]═Fe3[Fe(CN)6]2↓;
故答案为:3Fe2++2[Fe(CN)6]═Fe3[Fe(CN)6]2↓;
(3)高锰酸钾氧化草酸生成二氧化碳和水,本身被还原为二价锰离子,离子方程式:5H2C2O4+6H++2MnO4-═10CO2↑+2Mn2++8H2O;
故答案为:5H2C2O4+6H++2MnO4-═10CO2↑+2Mn2++8H2O;
(4)硫代硫酸在酸性环境下发生歧化反应生成硫沉淀和二氧化硫,离子方程式:2H++S2O32-=S↓+SO2↑+H2O;
故答案为:2H++S2O32-=S↓+SO2↑+H2O;
(5)碳酸根分步水解,以第一步水解为主,水解生成碳酸氢根离子和氢氧根离子,离子方程式:CO32-+H2O?HCO3-+OH-;
故答案为:CO32-+H2O?HCO3-+OH-;
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意多元弱酸分步水解,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用稀盐酸冲洗 | B. | 加稀盐酸溶解,再用蒸馏水冲洗 | ||
| C. | 用热的碳酸钠溶液冲洗 | D. | 加热,使碳酸盐分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加Fe(s)的量 | B. | 将容器的体积缩小一半 | ||
| C. | 升高温度 | D. | 通入水蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
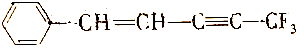 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 共平面的原子最多有19个 | B. | 共平面的原子至少有10个 | ||
| C. | 共平面的碳原子最多有11个 | D. | 共直线的碳原子最多有4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
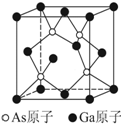 氮族元素和硼族元素在生产生活中有很重要的地位.
氮族元素和硼族元素在生产生活中有很重要的地位.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
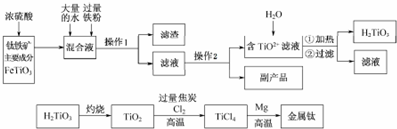
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| C. | ${\;}_{2}^{3}$He原子核内含有3个中子 | |
| D. | ${\;}_{2}^{4}$He最外层电子数为2,具有较强金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
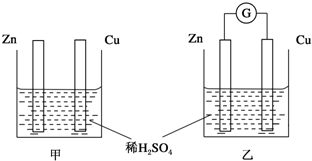
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com