
����Ŀ������һ���л����ת����ϵ��ͼ��ʾ��ת����ϵ�в��ַ�Ӧ��Ͳ���ʡ�ԣ��漰�Ļ�ѧ��Ӧ��Դ�ڽ̲ġ�
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��
��֪������Ȼ�߷��ӻ����Mr(��)��Mr(��)��28�������й��ƶ���ȷ����(����)
A. �����л�������Ԫ����ͬ
B. �ס��ҡ������ܷ���������Ӧ
C. �췢����ȥ��Ӧ���ɼ�
D. ��ȥ��������������ķ���������NaOH��Һ������
���𰸡�A
������������������Ϊ������������������+������������α���Ӧ���˹���ΪRCH2OH![]() RCHO
RCHO![]() RCOOH��RCOOH+RCH2OH
RCOOH��RCOOH+RCH2OH![]() RCOOCH2R+H2O��Mr(��)��Mr(��)��28����RΪ��CH3�����������졢������ΪCH3CH2OH��CH3CHO��CH3COOH��CH3COOCH2CH3��������Ȼ�߷��ӻ����������C6H10O5��n������ˮ�ⷴӦ�����ң������������������Ƿ������ͷ�Ӧ����CH3CH2OH��A���Щ�л�������Ԫ�ض���C��H��O����ȷ��B��ҡ����к�ȩ���ܷ���������Ӧ�������ڷǻ�ԭ���Dz��ܷ���������Ӧ������C���ΪCH3COOH�����������������Ӧ���ɼ�������D���ΪCH3COOCH2CH3��CH3COOCH2CH3��NaOH��Һ�лᷢ��ˮ�⣬������NaOH��Һ��ȥ���������л��е����ᣬ��ȥ���������л��е�����Ӧ���뱥��Na2CO3��Һ����Һ������ѡA��
RCOOCH2R+H2O��Mr(��)��Mr(��)��28����RΪ��CH3�����������졢������ΪCH3CH2OH��CH3CHO��CH3COOH��CH3COOCH2CH3��������Ȼ�߷��ӻ����������C6H10O5��n������ˮ�ⷴӦ�����ң������������������Ƿ������ͷ�Ӧ����CH3CH2OH��A���Щ�л�������Ԫ�ض���C��H��O����ȷ��B��ҡ����к�ȩ���ܷ���������Ӧ�������ڷǻ�ԭ���Dz��ܷ���������Ӧ������C���ΪCH3COOH�����������������Ӧ���ɼ�������D���ΪCH3COOCH2CH3��CH3COOCH2CH3��NaOH��Һ�лᷢ��ˮ�⣬������NaOH��Һ��ȥ���������л��е����ᣬ��ȥ���������л��е�����Ӧ���뱥��Na2CO3��Һ����Һ������ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŵ�����ʪ����ͭ�ļ��ء����������Ϊͭ������ӦΪFe+CuSO4==FeSO4+Cu���йظ÷�Ӧ��˵����ȷ���� �� ��
A. Fe�������� B. CuSO4�ǻ�ԭ��
C. Fe������ D. CuSO4����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.0500molL��1H2C2O4����Ԫ���ᣩ��Һ�ζ�25.00mL0.1000molL��1NaOH��Һ���õζ�������ͼ������˵����ȷ���ǣ� �� 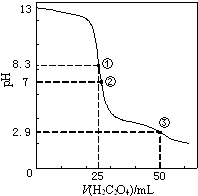
A.�����ʾ��Һ�У�c��H+��+c��H2C2O4��+c��HC2O4����=c��OH����
B.�����ʾ��Һ�У�c��HC2O4����+2c��C2O42����=c��Na+��+c��H+��
C.�����ʾ��Һ�У�c��Na+����c��HC2O4������c��H2C2O4����c��C2O42����
D.�ζ������п��ܳ��֣�c��Na+����c��C2O42����=c��HC2O4������c��H+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��M��Ԫ�����ڱ���ԭ������������������ֶ�����Ԫ�أ��������Ϣ���±���
Ԫ�� | �����Ϣ |
X | X��һ�ֺ��ص�ԭ�Ӻ���û������ |
Y | Yԭ�ӵĺ������ռ��4��ԭ�ӹ�� |
Z | Z����̬�⻯����ʹʪ��ĺ�ɫʯ����ֽ���� |
R | R�ǵؿ��к�����ߵ�Ԫ�� |
M | M�ĵ�������ˮ���ҷ�Ӧ�����ɵ�ǿ���к��е�������ͬ���������� |
��1��Y��Z��R�ĵ�һ�����ܴӴ�С��˳��������Ԫ�ط��ţ�
��2��Z��R������⻯�����ȶ���ǿ���� �� �е�ߵ������ѧʽ��
��3������������3��Ԫ����ɵij��������������pH=3�ļ���Һ����ˮ����c��H+��=10��3mol/L����Ļ�ѧʽ�� ��
��4��ֱ���ͷ���Y2Z2������ԭ�Ӷ��ﵽ8�����ȶ��ṹ��������ЦҼ���м��ĸ���֮���� ��
��5��������0.58gY4H10��ȫȼ�շų�29kJ����������д��Y4H10ȼ���ȵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������Ϊx��Ԫ��E�����ڱ���λ��A��B��C��D����Ԫ���м䣨��ͼ��ʾ������A��B��C��D����Ԫ�ص�ԭ������֮�Ͳ������ǣ���ϵ���ϵ��O��Ԫ�س��⣩�� �� 
A.4x
B.4x+6
C.4x+10
D.4x+14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ��׳��뻯ѧʽ��Ӧһ�µ��ǣ� ��
A.����NaOH
B.���SO3
C.����Fe2O3
D.�մ�NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�У�������H++OH-=H2O��ʾ����
A. 2NaOH+H2SO4 =Na2SO4+2H2O B. Ba(OH)2+2HCl=BaCl2+2H2O
C. Cu(OH)2+2HNO3=Cu(NO3)2+2H2O D. KOH+HCl=KCl+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120 �������£�һ��������ij�л���(ֻ��C��H��O����Ԫ���е����ֻ�����)������O2��ȼ�պ�����������ͨ��ŨH2SO4��ŨH2SO4����2.7 g����ͨ����ʯ�ң���ʯ������4.4 g���Ը��л�����к˴Ź����������ͼ����ͼ��ʾ��

�����������( )
A. CH3CH3 B. CH3CH2COOH
C. CH3CH2OH D. CH3CH(OH)CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�ķǽ���Ԫ�أ��㷺��������Ȼ�磬�ش��������⣺
��1����̬��ԭ�ӵļ۲�����Ų�ͼ��___________________��
��2�������ʵ�һ�ֽṹΪ![]() ���ӻ���ʽΪ___________��������__________(��������������������)��ˮ��
���ӻ���ʽΪ___________��������__________(��������������������)��ˮ��
��SO42-��CS2��CO32-�����ɴ�С��˳����_____________��
(3)���������仯�����ںϽ�����Լ������ȷ���Ӧ�ù㷺��
��NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69pm��78pm�����۵�FeO__________NiO(����<������>��)
��������������������ͬ�������壬����������ͼ�������������־�������ԭ�ӵ���λ��֮��Ϊ_________��

��4��ij����������������ͼ1��ʾ����Aԭ��Ϊ�����Ķ��㣬Aλ������Ca��Sr��Ba��Pb����Bλ��V��Cr��Mn��Fe��ʱ�����ֻ��������CMRЧӦ��

����A��B��O ��ʾ�������⾧��Ļ�ѧʽ��____________��
����֪LaΪ+3�ۣ������Ƶȶ���Ԫ��A���ʱ�����γɸ��ϸ��ѻ�����La1-xAxMnO3(x<0.1)����ʱһ������ת��Ϊ+4�ۡ����²�����ijһ�¶ȸ����з����������š�������˳�ż��������뵼���ת�䣬��La1-xAxMnO3�����������ļ��̵����ʵ���֮��Ϊ_________��(��x��ʾ)
�������й�˵����ȷ����__________________��
A.�硢�̡����ֱ�λ�����ڱ�f��d��P��
B.���ĵ�һ�����ܱȵ��ĵ�һ�����ܴ�
C.�̵ĵ縺��Ϊ1.59��Cr�ĵ縺��Ϊ1.66��˵���̵Ľ����Աȸ�ǿ
D.���Ķѻ���ʽ�����ͬ������ѻ���ʽ��ͼ2��ʾ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com