
| A. | 胆矾是纯净物,属于强电解质 | B. | 非金属氧化物一定是酸性氧化物 | ||
| C. | 含金属元素的离子一定都是阳离子 | D. | 阳离子只有氧化性 |
分析 A、胆矾属于盐,属于纯净物,在水溶液中能完全电离;
B、酸性氧化物是指能够与碱反应只生成盐和水的氧化物;
C、结合高锰酸根离子含有金属锰元素来回答;
D、阳离子可能既有氧化性又有还原性,比如处于中间价态的金属阳离子.
解答 解:A、胆矾是五水硫酸铜,是纯净物,在水溶液中能完全电离,属于强电解质,故A正确;
B、非金属氧化物不一定是酸性氧化物,如NO、CO、NO2,都不是酸性氧化物,故B错误;
C、高锰酸根离子含有金属锰,是阴离子,故C错误;
D、阳离子可能既有氧化性又有还原性,如亚铁离子,故D错误.
故选A.
点评 本题考查了盐、氧化物、强电解质的概念及其联系,难度不大,注意把握相关概念的内涵和外延,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 合金:都具有金属特性和固定的熔点 | |
| B. | 金属延展性:金属受外力发生形变,但金属键没有被破坏 | |
| C. | 金属导热性:金属内自由电子传递热量 | |
| D. | 用钢材作建材而不是纯铁:钢材的硬度一般比纯铁的硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始后,反应要放出能量 | |
| B. | 建立平衡状态时c(N2)<3 mol/L | |
| C. | 该条件下,平衡时N2的体积分数为$\frac{1}{14}$ | |
| D. | 反应条件变化时,其K值也一定发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2S+SO2═3S+2H2O | B. | Fe+Cu2+═Fe2++Cu | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
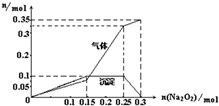 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.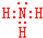 ,空间构型为三角锥形.
,空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
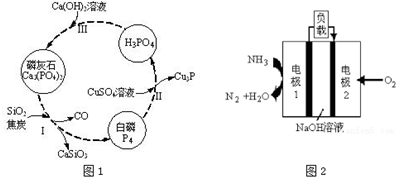
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
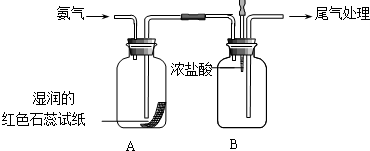 某小组同学利用如图所示装置探究氨气的性质.
某小组同学利用如图所示装置探究氨气的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业电解饱和食盐水模拟装置的结构如图所示:
工业电解饱和食盐水模拟装置的结构如图所示: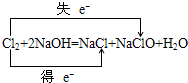 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 向氢氧化钠溶液中通入二氧化碳:2OH-+CO2=CO32-+H2O | |
| C. | 澄清石灰水与稀盐酸反应:Ca (OH)2+2H+=Ca2++2H2O | |
| D. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com