
【题目】某温度下,向2L恒容密闭容器中充入1.0molA和1.0molB,发生反应A(g)+B(g)![]() C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是

A.反应在前5s的平均速率v(A)= 0. 17mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 molA、0.20 molB和1.0molC,反应达到平衡前v(正)<v(逆)
【答案】D
【解析】
试题分析:反应在前5s的平均速率v(A)= ![]() 0.015mol/(Ls),故A错误;保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则A的浓度增大,平衡逆向移动,则反应的△H<0,故B错误;相同温度下,起始时向容器中充入1.0molC,根据等效平衡原理,达到平衡时A的物质的量为0.8mol, C的转化率为80%,若起始时向容器中充入2.0molC,相当于加压,平衡正向移动,所以C的转化率小于80%,故C错误;根据表格中的数据,起始时向容器中充入0.80molA、0.80molB和0.2molC,为平衡状态,v(正)=v(逆),向容器中充入0.20molA、0.20molB和1.0molC,反应逆向进行,故v(正)<v(逆),故D正确。
0.015mol/(Ls),故A错误;保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则A的浓度增大,平衡逆向移动,则反应的△H<0,故B错误;相同温度下,起始时向容器中充入1.0molC,根据等效平衡原理,达到平衡时A的物质的量为0.8mol, C的转化率为80%,若起始时向容器中充入2.0molC,相当于加压,平衡正向移动,所以C的转化率小于80%,故C错误;根据表格中的数据,起始时向容器中充入0.80molA、0.80molB和0.2molC,为平衡状态,v(正)=v(逆),向容器中充入0.20molA、0.20molB和1.0molC,反应逆向进行,故v(正)<v(逆),故D正确。


科目:高中化学 来源: 题型:
【题目】有机化合物F是治疗感冒药的主要成分之一,其合成路线如下:

已知:
① (R、R'、R"均代表烃基;X代表卤素原子);
(R、R'、R"均代表烃基;X代表卤素原子);
②A蒸气的密度是相同条件下氢气密度的53倍。
请回答下列问题:
(1)D中官能团的名称为______。
(2)E的结构简式为____________。
(3)写出反应②的化学方程式:___________________。
(4)B的消去反应产物可以用于合成高分子化合物G,G的结构简式是________;若G的平均相对分子质量为9000,则其平均聚合度约为___________(保留整数)。
(5)符合下列条件的C的同分异构体有________种(考虑顺反异构)
①能与氢氧化钠溶液反应 ②分子中含有两种官能团。
任写一种存在顺反异构的同分异构体的结构简式__________(写反式结构);
(6)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同_____(填字母序号)。
A.核磁共振仪 B.元素分析仪 C.质谱仪 D.红外光谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中完全正确的一组是( )
①常温常压下,1 mol甲基(—CH3)所含的电子数为10NA
②由Cu、Zn和稀硫酸组成的原电池中,若Cu极生成0. 2 g H2,则电路通过电子0.2NA
③在标准状况下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA
④常温常压下,16 g O3所含的原子数为NA
⑤1 mol C10H22分子中共价键总数为31NA
⑥1 mol Cl2发生反应时,转移的电子数一定是2NA
⑦标准状况下22. 4 L水中含分子数为NA
A. ①②③④⑤ B. ②④⑤⑥⑦ C. ②④⑤ D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸吸收塔排出的尾气需要处理才能排放到大气中,其处理方法为:先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
请计算:
(1)该铵盐中氮元素的质量分数是____%。
(2)若铵盐质量为15.00g,浓硫酸增加的质量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A在铜催化下被氧化的生成物不能发生银镜反应。有关A的转化关系如下:
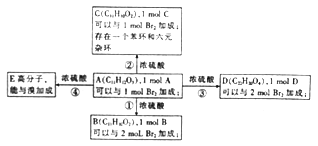
(1)属于酯类的化合物是___________(填代号)。
(2)①的反应类型是___________ ,理由是___________________________。
(3)已知A中的苯环只有一个取代基,A的结构式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用1 L 1 molL-1Na2SO3溶液吸收SO2时,溶液pH随SO2的物质的量的变化如图所示,下列说法正确的是
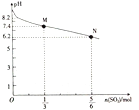
A. 当吸收液呈中性时:c( Na+ ) = c( HSO3-) + 2c(SO32-)
B. M 点时溶液中:c(SO32-)>c(HSO3-)
C. Na2SO3溶液中:c(Na+)>32-)>c(HSO3-)> c(OH-)>c(H+)
D. 向N点的吸收液中加水可使溶液的pH由6. 2升高到7. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇来源丰富、价格低廉,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g) ![]() CH3OH(g) △H = —91kJ/mol。
CH3OH(g) △H = —91kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —580kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —570kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H = ________________。
若在恒温恒容的容器内进行反应CO(g)+2H2(g) ![]() CH3OH(g),下列表示该反应没有达到平衡状态的有________(填字母序号)。
CH3OH(g),下列表示该反应没有达到平衡状态的有________(填字母序号)。
A.CO百分含量保持不变 B.容器中混合气体的密度不变化
C.有1个H—H键生成的同时有 3个C—H键生成 D.容器中混合气体的压强不变化
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g) ![]() H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O) 若起始时c(CO)=1mol/L-1,c(H2O)=1mol/L-1,试回答下列问题:
H2(g)+ CO2(g) △H<0,某温度下该反应达到平衡时,c(H2)·c(CO2)= c(CO)·c(H2O) 若起始时c(CO)=1mol/L-1,c(H2O)=1mol/L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol/L-1,则此时该反应v(正)__________v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为________。
(3)某实验小组设计了甲醇以氢氧化钾为电解质溶液的燃料电池装置。
①试想该电池工作时,OH— 向_______极移动(填“负”或“正”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为______________________。总反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 足量乙酸与碳酸钠溶液反应: 2 CH3COOH +CO32-→ 2CH3COO-+CO2↑+H2O
B. 醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O
C. 苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D. 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-![]() CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com