
分析 给出八种离子,形成四种可溶性物质,这个可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定.如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;Na+对应CO32-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
①中由于C盐是蓝色的,所以C为CuSO4;
②四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;而D生成无色气体,则为二氧化碳,即D为Na2CO3.
解答 解:由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4,Na+对应CO32-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
①中由于C盐是蓝色的,所以C为CuSO4;
②四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;而D生成无色气体,则为二氧化碳,即D为Na2CO3.
综上所述:A为BaCl2;B为AgNO3;C为CuSO4;D为Na2CO3;
(1)依据推断结果可知A为BaCl2,C为CuSO4 ,故答案为:BaCl2;AgNO3;CuSO4 ;Na2CO3;
(2)A为(BaCl2)和D(Na2CO3)反应的方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl,即Ba2++CO32-=BaCO3↓,盐酸与D(Na2CO3)反应的离子反应方程式为:CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O.
点评 本题考查了离子性质的应用,离子共存的判断,物质性质的分析应用,反应离子方程式的书写,阴阳离子的特征反应现象是判断的依据和解题关键.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 第1A族均为碱金属元素 | |
| B. | 最外层有两个电子的原子一定在第ⅡA族 | |
| C. | 元素的最高化合价等于其原子的最外层电子数 | |
| D. | 第ⅦA族元素的阴离子还原性越强,其气态氢化物的稳定性越弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
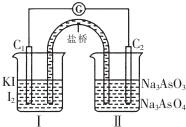 已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:
已知可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,设计如图装置,进行下述操作:| A. | ①操作过程中C1棒上发生的反应为2I--2e-═I2 | |
| B. | ②操作过程中盐桥中的阳离子移向(Ⅰ)烧杯 | |
| C. | 若将微安表换成惰性电极电解饱和食盐水的装置,在①操作过程中与C1棒连接的电极上有Cl2产生 | |
| D. | 若将微安表换成电解精炼铜装置,在②操作过程中与C2棒连接的为纯铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于反应前后分子数相等,所以加压后,平衡不移动 | |
| B. | 平衡时c(H2O)(g)、c(CO)、c(H2)保持不变 | |
| C. | 达到平衡时,c(H2O)(g)═c(CO)=c(H2) | |
| D. | 升高温度,V正增大,V逆减小,所以平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{46}^{102}$Pd和${\;}_{46}^{103}$Pd互为同位素 | |
| B. | 钯是第五周期元素 | |
| C. | Pd2+核外有48个电子 | |
| D. | ${\;}_{62}^{108}$Pd的原子核内有62个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1 mol醋酸分子中含有共价键的个数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g),△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O,△H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2 则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{△}^{HBr溶液}$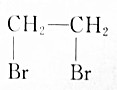 | |
| B. | CH3CH2Br$→_{光照}^{Br_{2}}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{△}^{NaOH醇溶液}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH3$→_{光照}^{Br_{2}}$CH2BrCH2Br | |
| D. | CH3CH2Br$→_{△}^{NaOH醇溶液}$CH2═CH2$\stackrel{溴水}{→}$CH2BrCH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com