
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:8 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
分析 化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,根据n=$\frac{m}{M}$计算二氧化碳、水的物质的量,进而计算有机物中C、H原子数目之比,根据m=nM计算C、H元素质量,根据质量守恒定律计算判断化合物中是否含有O元素.
解答 解:化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,
8.8g二氧化碳的物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,
7.2g水的物质的量为$\frac{7.2g}{18g/mol}$=0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,
故化合物中N(C):N(H)=0.2mol:0.8mol=1:4,
由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,
综上分析可知,ACD错误,B正确,
故选D.
点评 本题考查有机物组成的确定,侧重考查质量守恒定律,题目难度不大,注意根据质量守恒判断是否含有氧元素.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | -109kJ•mol-1 | B. | -218kJ•mol-1 | C. | +109kJ•mol-1 | D. | +218kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
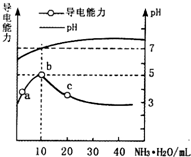 常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
常温下,向10ml 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | |
| B. | b点溶液pH=5,此时酸碱恰好中和 | |
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意点溶液均有c(H+)•c(OH-)=Kw=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯能使溴水褪色,是因为苯与溴发生了化学反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
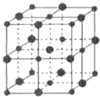 已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.
已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
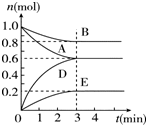 T℃、2L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体).回答下列问题.
T℃、2L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体).回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com