
下列说法正确的是
A.由分子构成的物质一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子中的化学键一定都是极性键
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在一瓶pH=1的无色溶液中,已检验出含有Ba2+、Ag+,则下列粒子:①Cl-、②Mg2+、③Cu2+、④NO 、⑤AlO
、⑤AlO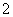 、⑥CO
、⑥CO 、⑦NH3·H2O,在此溶液中不能大量存在的正确组合是
、⑦NH3·H2O,在此溶液中不能大量存在的正确组合是
A.①②③⑥⑦ B.②③⑤⑥⑦
C.①③⑤⑥⑦ D.①②⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.1 mol/L CH3COOH溶液 加水稀释或加入少量CH3COONa晶体时都会引起
加水稀释或加入少量CH3COONa晶体时都会引起
( )
A.CH3COOH电离程度变大
B.溶液pH变大
C.溶液的导电能力减弱
D.溶液中c(H+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
[实验一] 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________(保留小数点后四位)。
[实验二] 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋 酸的pH,结果如下:
酸的pH,结果如下:
| 醋酸浓度(mol/L) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:________________________________________________________________________
________________________________________________________________________。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将________(填“增大”、“减小”或“不变”)。
[实验三] 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化
B.元素原子最外层电子排布呈周期性变化
C.元素的相对原子质量依次递增
D.元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 _________ ;它含有的化学键类型有 _________
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用高铁酸钠(Na2FeO4)对河水进行消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-转移
D.Na2FeO4能杀菌消毒是因为其具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,可逆反应N2(g)+3H2(g) 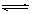 2NH3(g)达到平衡的标志是 ( )
2NH3(g)达到平衡的标志是 ( )
A.N2 H2 NH3 的浓度相等
B.1个N≡N键断裂的同时,有6个N-H键形成
C.N2 H2 NH3的分子数比为1:3:2
D.单位时间消耗n mol N2 ,同时生成3n mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com