
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |

分析 Ⅰ.(1)实验2和实验3主要是双氧水的浓度不同;
(2)实验2和实验4其他条件都相同,只有温度不同;
(3)试验1和实验2相比较,2中使用了催化剂,其他条件相同;
Ⅱ.(4)加入0.1mol•L-1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,说明此反应为可逆反应;
Ⅲ.(1)因为N2O4(g)?2NO2为可逆反应,反应达平衡时,反应容器中最后剩余的物质有NO2、N2O4;再根据平衡图象计算N2O4的物质的量;
(2)达到平衡状态时,正反应速率与逆反应速率相等,保持不变.
解答 解:Ⅰ.(1)实验2和实验3主要是双氧水的浓度不同,则实验目的为研究双氧水浓度不同,对化学反应速率的影响,
故答案为:H2O2的浓度;
(2)实验2和实验4其他条件都相同,只有温度不同,
故答案为:2;4;
(3)试验1和实验2相比较,2中使用了催化剂,其他条件相同,反应速率大,所用时间短,
故答案为:>;
Ⅱ.(4)加入0.1mol•L-1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,说明此反应为可逆反应,存在一定的限度,
故答案为:⑤;溶液出现血红色;
Ⅲ.(1)因为N2O4(g)?2NO2为可逆反应,反应达平衡时,反应容器中最后剩余的物质有NO2、N2O4;平衡时,n(NO2)=0.12mol/L×0.1L=0.012mol,则N2O4的物质的量为0.01mol-0.006mol=0.004mol,
故答案为:NO2、N2O4;0.004mol;
(2)达到平衡状态时,正反应速率与逆反应速率相等,保持不变,
故答案为:不变.
点评 本考点主要考查了影响化学反应速率的因素的探究,要好好利用控制变量法,化学反应速率中的计算,化学平衡的建立,三价铁离子的检验都属于基础知识的考查,注意灵活运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 还原性 H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | M与T形成的化合物能与NaOH溶液反应 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
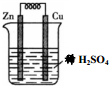
| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
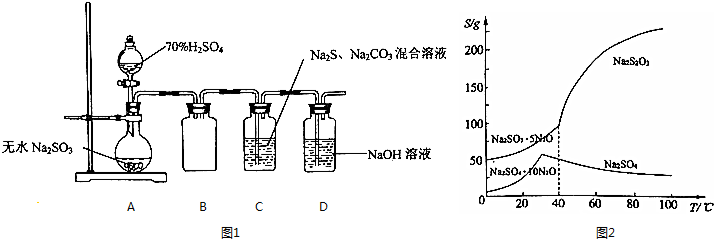
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 0.3molFeBr2与0.4molCl2在溶液中反应:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
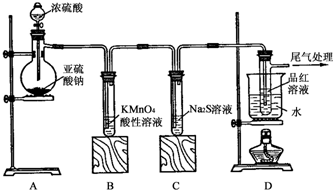
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
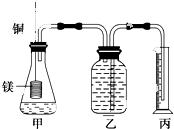 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com