
| A.由“BF3和SO3互为等电子体”,可推知二者均为非极性分子 |
| B.由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
| C.由“蒸干NaCl溶液得NaCl固体”,可推知蒸干MgCl2溶液得MgCl2固体 |
| D.由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大”,可推知C比S的非金属性弱 |
科目:高中化学 来源:不详 题型:填空题
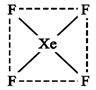
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 熔点/℃ | 沸点/℃ | 密度/g·cm—3 | 水 |
| CS2 | —110.8 | 46.5 | 1.26 | 难溶 |
| S2Cl2 | —76 | 138 | 1.75 | 水解 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.每一个水分子内含有两个氢键 |
| B.水分子间存在范德华力,所以水分子稳定 |
| C.分子间形成的氢键使水的熔点和沸点升高 |
| D.冰熔化时水分子内共价键发生断裂 |
 Na2Mn5O10,请写出电池总反应式 。
Na2Mn5O10,请写出电池总反应式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2与O3 | B.CO2与NO2 | C.CS2与NO2 | D.PCl3与BF3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.79×10-20 kJ | B.3.59×10-20 kJ | C.1.08×104 kJ | D.2.16×104 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.极性共价键; | B.非极性共价键; | C.配位键; | D.离子键;E.金属键;F.σ键;G.π键 |
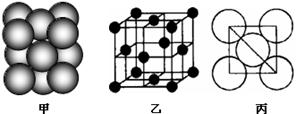
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com