
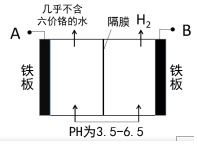
 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法不正确的是( )| A. | A接电源正极 | |
| B. | 阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O | |
| C. | 阴极区附近溶液pH减小 | |
| D. | 若不考虑气体的溶解,当收集到H2 13.44L时(标况),有0.1mol Cr2O72-被还原 |
分析 A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极;
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+;
C.阴极氢离子放电生成氢气,氢离子浓度降低;
D.根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据电子转移计算n(Fe2+),根据方程式计算被还原的Cr2O72-的物质的量.
解答 解:A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极,故A为电源正极,故A正确;
B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,发应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故B正确;
C.阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,故C错误;
D.13.44 L氢气的物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,根据电子转移守恒n(Fe2+)=$\frac{0.6mol×2}{2}$=0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×$\frac{1}{6}$=0.1mol,故D正确;
故选C.
点评 本题以废水处理为载体考查电解原理、氧化还原反应、化学计算等,为高考常见题型,侧重考查学生的分析、计算能力,注意仔细观察电解池判断电极,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [C2O42-]>0.63[CO32-] | B. | [C2O42-]>1.6[CO32-] | ||
| C. | [C2O42-]<1.6[CO32-] | D. | [C2O42-]<0.63[CO32-] | ||
| E. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
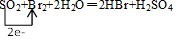 ,
,
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
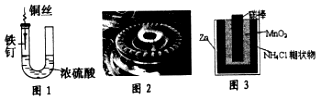
| A. | 图1中,铁钉易被腐蚀 | |
| B. | 图2中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| C. | 图3中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| D. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Ⅰ达平衡时,A、B、C各增加1mol,则C转化率将一定增大 | |
| B. | 若向Ⅰ平衡体系中在加入1molA和3molB,C的体积分数若大于x,可断定n>3 | |
| C. | 若Ⅱ体系起始物质的量满足9a+c=3b,则可判断n=3 | |
| D. | 若n=2,则Ⅱ体系起始物质的量应满足2a+1<b<3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com