
分析 (1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O;根据原子守恒判断b、c关系;
(2)①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6;
②该反应中Fe元素化合价由+3价升高到+6价,Cl元素化合价由+1价变为-1价,转移电子数为6,根据转移电子和高铁酸根离子之间关系式计算转移电子物质的量、根据转移电子和还原产物之间关系式计算还原产物物质的量.
解答 解:(1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O,配平后方程式为:2FeSO4+6Na2O2 $\frac{\underline{\;高温\;}}{\;}$2Na2FeO4+2Na2O+2Na2SO4+O2↑,
故答案为:Na2O;b=2c+8;
(2 ) ①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,C1O-具有强氧化性,所以C1O-是反应物,生成物是C1-,Cl元素化合价由+1价变为-1价,转移电子数为6,溶液在碱性条件下进行,则氢氧化根离子参加反应,生成水,反应方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中Fe元素化合价由+3价升高到+6价,则该反应中转移电子数为6,每生成1mol FeO42-转移电子物质的量=$\frac{6mol}{2}×1$=3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量=$\frac{0.3mol}{6}×3$=0.15mol,
故答案为:3;0.15.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,正确判断各个物理量之间关系式是解本题关键,难点是化学反应方程式的配平,要注意原子守恒、转移电子守恒及电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>HBr>HI | |
| B. | 微粒的半径:Cl->Na+>Mg2+ | |
| C. | 离子的还原性:S2->Cl->F- | |
| D. | 电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用渗析的方法除去淀粉中的氯离子 | |
| C. | 用结晶的方法分离氯化钠和硝酸钾 | |
| D. | 用分液的方法除去四氯化碳中混有的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
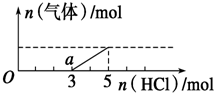 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 常温下,a点溶液pH>7 | |
| C. | 标准状况下,通入CO2的体积为4.48L | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com