

| ��� | ʵ�鷽�� | ʵ������ | ���� |
| �� | ����ɫ����B����ˮ�У� �����ܽ⣬��ȴ�ᾧ������ | �õ���ɫ�������ɫ��Һ | �� |
| �� | ȡ������Һ���Թ��У� ����ϡHNO3��AgNO3��Һ | ���ɰ�ɫ���� | ��Һ��Cl- |
| �� | �����ɫ���壬�ⶨ�۵� | ��ɫ������122.4��������ȫ�ۻ� | ��ɫ�����DZ����� |
���� һ�����ļױ���������KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ������ͼ���̷����������ͻ���δ��Ӧ�ļױ���������������ˮ���ױ�������ˮ���������ܵ�Һ����÷�Һ�������룬����ʵ��Ŀ��֪���Ӷ��õ��л����ˮ�࣬�л����к��мױ���ˮ���к��б����ᣬ�л����еļױ����������õ���ɫҺ��A��A�Ǽױ�����ˮ�������ữ������Ũ�������ݱ�������ܽ��֪���õ��Ĺ���B�DZ����ᣮ
��1�����뻥�����ܵ�Һ����÷�Һ���������뻥���ҷе㲻ͬ��Һ�����������
��2���ױ���ʹ���Ը��������Һ��ɫ��
��3����Ϸ�Ӧ��ѧ����ʽ�����ɵIJ���������з��벽���������ɫ����B�DZ�������KCl�Ļ������ݱ������۵�122.4�棬��25���95��ʱ�ܽ�ȷֱ�Ϊ0.3g��6.9g���ȼ��鱽����ļ����ټ����Ȼ��صĴ��ڣ�
��4���������KOH��Һ��������кͷ�Ӧ�����ݱ������KOH֮��Ĺ�ϵʽ���㱽������������Ӷ����㱽���������������
��� �⣺һ�����ļױ���������KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ������ͼ���̷����������ͻ���δ��Ӧ�ļױ���������������ˮ���ױ�������ˮ���������ܵ�Һ����÷�Һ�������룬����ʵ��Ŀ��֪���Ӷ��õ��л����ˮ�࣬�л����к��мױ���ˮ���к��б����ᣬ�л����еļױ����������õ���ɫҺ��A��A�Ǽױ�����ˮ�������ữ������Ũ�������ݱ�������ܽ��֪���õ��Ĺ���B�DZ����ᣮ
��1�����뻥�����ܵ�Һ����÷�Һ��������������ͼ�У�ˮ����л�����ܣ����Բ��÷�Һ�������룬������IΪ��Һ���л��������ʻ����ҷе㲻ͬ�����Կ��Բ����������룬������IIΪ���ʴ�Ϊ����Һ������
��2��ͨ�����Ϸ���֪��A�Ǽױ����ױ����м��������ܱ����Ը����������Ϊ�������ʹ���Ը��������Һ��ɫ������������Ը��������Һ����ױ����ʴ�Ϊ���ױ�������KMnO4��Һ����Һ��ɫ��
��3��ͨ���ⶨ��ɫ����B���۵㣬��������115�濪ʼ�ۻ����ﵽ130��ʱ�����������ۣ��Ʋ��ɫ����B�DZ�������KCl�Ļ����Ȼ��ؿ����������ữ����������Һ���������ӵĴ��ڣ����ñ�������ܽ��������25���95��ʱ�ܽ�ȷֱ�Ϊ0.3g��6.9g�����ò�ͬ�¶��µ��ܽ�ȣ���������õ������ͨ���ⶨ�۵��ж��Ƿ�Ϊ�����
�ʴ�Ϊ��
| ��� | ʵ�鷽�� | ʵ������ | ���� |
| �� | ����ɫ����B����ˮ�м��ȣ��ܽ⣬��ȴ������ | �õ���ɫ�������ɫ��Һ | -- |
| �� | ȡ������Һ���Թ��У�����2-3��AgNO3��Һ | ���ɰ�ɫ���� | ��Һ����Cl- |
| �� | �����ɫ���壬����ʹ���ڻ��������۵㣻 | ��ɫ������122.4��������ȫ�ۻ� | ��ɫ�����DZ����� |
���� ���⿼�����������ʵ�ʵ������жϣ����ʷ����������Լ�ѡ�������������Ӧ�ã����ʳɷֵ�ʵ����Ʒ��������衢�Լ�����Ʒ���ȵļ��㣬ע�����ʱ�����л�ȡ���õ���Ϣ����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1����������������
��1���������������� ��
�� ������ ��C��CH3��4��
������ ��C��CH3��4��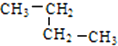 �����л�Ϊͬ���칹����Ǣڢܣ�����ţ��������
�����л�Ϊͬ���칹����Ǣڢܣ�����ţ�������� ��E�Ľṹ��ʽΪ
��E�Ľṹ��ʽΪ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����������һ�ָ�Ч������Ư������Ҫ�����ġ����顢ֽ����Ư�ף��������ƣ�NaClO2������Һ�п�����ClO2��HClO2��ClO2-��Cl-�ȣ�����HClO2��ClO2������Ư�����ã���ClO2���ж����壮���ⶨ��25��ʱ����ֺ�����pH�仯�����ͼ��ʾ��Cl-û�л������������з�����ȷ���ǣ�������
����������һ�ָ�Ч������Ư������Ҫ�����ġ����顢ֽ����Ư�ף��������ƣ�NaClO2������Һ�п�����ClO2��HClO2��ClO2-��Cl-�ȣ�����HClO2��ClO2������Ư�����ã���ClO2���ж����壮���ⶨ��25��ʱ����ֺ�����pH�仯�����ͼ��ʾ��Cl-û�л������������з�����ȷ���ǣ�������| A�� | �������������������½��ȶ� | |
| B�� | 25��ʱ��HClO2�ĵ���ƽ�ⳣ������ֵKa=10-6 | |
| C�� | pHԽ��Ư����Ư������Խ�� | |
| D�� | 25�棬pH=3ʱ��NaClO2��Һ�У�c��Na+��+c��H+��=c��ClO2-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪��CH3CH2OH+NaBr+H2SO4��Ũ�� $\stackrel{��}{��}$ CH3CH2Br+NaHSO4+H2O��
��֪��CH3CH2OH+NaBr+H2SO4��Ũ�� $\stackrel{��}{��}$ CH3CH2Br+NaHSO4+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 | 100 |
| c��N2O4�� mol/L | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
| c��NO2�� mol/L | 0.000 | 0.060 | 0.100 | 0.120 | 0.120 | 0.120 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol/L | B�� | 0.1mol/L | C�� | 0.001mol/L | D�� | 10mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com