
| A. | NH4+ | B. | ClO3- | C. | H3O+ | D. | H2S |
分析 价层电子对几何构型为四面体说明该微粒的价层电子对是4,价层电子对=σ 键电子对+中心原子上的孤电子对;空间构型为V形说明该微粒中含有2个孤电子对,据此分析解答.
解答 解:A.NH4+中价层电子对个数=4+$\frac{1}{2}$(5-1-4×1)=4,且不含孤电子对,价层电子对几何构型和离子的空间构型均为正四面体形,故A错误;
B.ClO3-离子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(7+1-3×2)=4,价层电子对互斥模型为四面体型,且含有一个孤电子对,所以离子空间构型为三角锥形,故B错误;
C.H3O+离子中价层电子对=3+1=4,所以其价层电子对几何构型为正四面体,该离子中含有一个孤电子对,所以其空间构型为三角锥型,故C错误;
D.H2S分子中S原子价层电子对=2+$\frac{1}{2}$(6-2)=4,价层电子对互斥模型为四面体型,且含有2个孤电子对,所以S原子采用sp3杂化,为V形结构,故D正确;
故选D.
点评 本题考查了微粒空间构型的判断,题目难度中等,先根据价层电子对判断VSEPR模型,去掉孤电子对就是其实际空间构型,这是高考的热点、学习的重点.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:填空题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AgNO3溶液滴入氨水中制银氨溶液 | |
| B. | 苯酚与苯甲醇(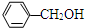 )分子组成相差一个-CH2原子团,因而它们互为同系物 )分子组成相差一个-CH2原子团,因而它们互为同系物 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 苯酚分子中由于羟基对苯环的影响,使苯环上的氢原子容易被取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X<Y | B. | 电负性:X<Y | C. | 离子半径:X>Y | D. | 原子半径:X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com