
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
分析 在硫酸铜晶体结晶水含量测定中,加热前后质量的减少量即是失去结晶水的质量,质量差偏大,使n值偏大,若质量差偏小,使n值偏小,据此进行解答.
解答 解:A.加热时间过长,部分变黑等都将导致硫酸铜分解固体变黑说明硫酸铜分解生成CuO与SO3,造成加热前后固体的质量差偏大,使测量结果偏高,故A错误;
B.坩锅内附有不分解的杂质,而加热前后固体的质量差不变,测量结果不变,故B错误;
C.加热过程中有少量晶体溅出,造成加热前后固体的质量差偏大,使测量结果偏高,故C错误;
D.晶体不纯,含有不挥发杂质,造成加热前后固体的质量差偏小,使测量结果偏低,故D正确;
故选D.
点评 本题考查硫酸铜晶体中结晶水的测定,题目难度不大,明确测定方法为解答关键,注意分析误差时从导致加热前后的质量差进行判断,试题培养了学生的化学实验能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
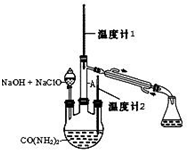 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
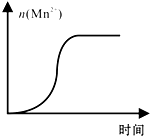 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:| KMnO4酸性溶液浓度(mol•L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol•L-1 | 体积(mL) | 浓度/mol•L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
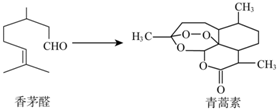 中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )
中国科学家屠呦呦因为创制了新型抗疟疾-青蒿素,获得2015年诺贝尔奖.青蒿素可由香茅醛为原料制取,下列说法错误的是( )| A. | 香茅醛能使Br2的CCl4溶液褪色 | B. | 青蒿素分子式为C15H22O5 | ||
| C. | 青蒿素含有和H2O2相同的过氧键 | D. | 青蒿素能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com