
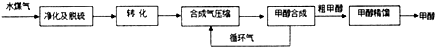
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
分析 (1)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低;
(2)①计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,进而判断正、逆反应速率的相对大小;
②与表中数据相比,根据氢气浓度变化量计算甲醇的浓度变化量,进而计算平衡时甲醇的浓度,再根据v=$\frac{△c}{△t}$计算v(CH3OH);
(3)合成气进行循环,可以提高原料利用率及生成物的产率;
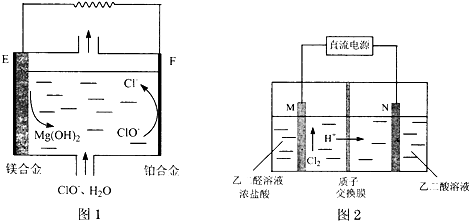
(4)原电池中失电子的为负极;正极上ClO-得电子生成氯离子;
(5)①N电极上HOOC-COOH得电子,再氢离子参与反应条件下生成HOOC-CHO;
②2mol H+通过质子交换膜,则电池中转移2mol电子,N极电极反应式为:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,M极电极反应式为:OHC-CHO-2e-+H2O═HOOC-CHO+2H+,两极均有乙醛酸,再结合电极方程式计算.
解答 解:(1)该反应正反应为放热反应,应选择催化活性高、速度快、反应温度较低,故选择Z,
故答案为:Z;催化活性高、速度快、反应温度较低;
(2)①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=$\frac{0.4}{0.{2}^{2}×0.1}$=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,故答案为:>;
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol•L-1,与表中数据相比,可知氢气的浓度变化量为0.4mol/L-0.2mol/L=0.2mol/L,故甲醇的浓度变化量为0.2mol/L×$\frac{1}{2}$=0.1mol/L,即平衡时甲醇为0.4mol/L-0.3mol/L,故v(CH3OH)=$\frac{0.3mol/L}{10min}$=0.03mol/(L•min),
故答案为:0.03;
(3)生产过程中,合成气要进行循环,提高原料CO、H2的利用率,
故答案为:提高原料CO、H2的利用率(或提高产量、产率亦可);
(4)“镁-次氯酸盐”燃料电池中失电子的为负极,则Mg为负极;正极上ClO-得电子生成氯离子,则正极的电极反应式为:ClO-+2e-+H2O═Cl-+2OH-;
故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
(5)①N电极上HOOC-COOH得电子生成HOOC-CHO,则电极反应式为:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,
故答案为:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
②N极电极反应式为:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,M极电极反应式为:OHC-CHO-2e-+H2O═HOOC-CHO+2H+,2mol H+通过质子交换膜,则电池中转移2mol电子,可知每一极生成1mol乙醛酸,由于两极均有乙醛酸生成所以生成的乙醛酸为2mol.
故答案为:2.
点评 本题考查化学平衡计算、原电池原理和电解池原理,是对学生综合能力的考查,(5)中乙醛酸的计算为易错点,学生容易忽略两极都生成乙醛酸,题目难度中等.


科目:高中化学 来源: 题型:填空题
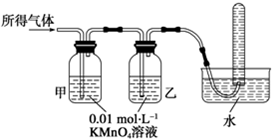 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
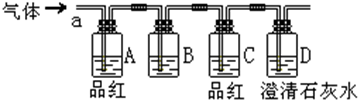
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
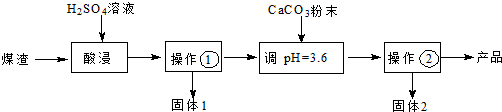
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2 | B. | CH3CH═CHCH3 | C. | CH3CH═CH2 | D. | CH2═CHCH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
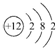 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该元素位于第3周期第ⅡA族 | B. | 该元素位于第2周期第Ⅷ族 | ||
| C. | 该元素位于第2周期第ⅡA族 | D. | 该元素位于第4周期第ⅡB族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com