
 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.| 1.6mol |
| 2mol |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Mg-2e=Mg2+ |
| B、放电时Mg2+向正极区移动 |
| C、充电时:阳极反应 Mo3S4+xMg2++2xe-═MgxMo3S4 |
| D、充电时,电池的负极接充电电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
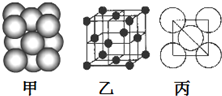 A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
A,B,C,D,E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57;B原子的L层P轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同,E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com