
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。


(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I的反应速率v(I)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 molL-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
【答案】 As2O5(s)=As2O3(s)+O2(g ) △H=+295.4 kJ/mol ac 0.003 mol/(L·min) 4.5×106 小于 淀粉 50.50% SO2 2H2O2+H2O+As2O3=2H3AsO4
【解析】试题分析:(1)根据图1可知,1 molAs2O5分解生成1 mol As2O3和1mol O2 吸收295.4 kJ能量;(2)①a.溶液颜色保持不再变化 ,说明碘单质的浓度不变; b.c(AsO33-)+c(AsO43-)为定值等于0.06 mol/L;c.AsO43-的生成速率等于I2的生成速率,正逆反应速率相等; d.  为定值等于1:1;
为定值等于1:1;
②根据![]() 计算0~10 min内I的反应速率。
计算0~10 min内I的反应速率。
③利用“三段式”计算平衡常数K。
④升高温度,溶液中AsO43-的平衡转化率减小,说明平衡逆向移动。
(3)②根据淀粉遇碘变蓝色选择指示剂。根据关系式计算试样中As2O5的质量分数。
(4)根据元素守恒As4S4在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为SO2,双氧水将As2O3氧化为H3AsO4,根据电子守恒化学方程式。
解析:(1)根据图1可知,1 molAs2O5分解生成1 mol As2O3和1mol O2 吸收295.4 kJ能量, As2O5分解为As2O3的热化学方程式为As2O5(s)=As2O3(s)+O2(g ) △H=+295.4 kJ/mol;(2)①a.溶液颜色保持不再变化 ,说明碘单质的浓度不变,一定达到平衡状态,故a正确; b.c(AsO33-)+c(AsO43-)为定值等于0.06 mol/L,c(AsO33-)+c(AsO43-)不再变化不一定平衡,故b错误;c.AsO43-的生成速率等于I2的生成速率,正逆反应速率相等,一定平衡,故c正确; d. 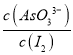 为定值等于1:1,
为定值等于1:1, 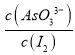 保持不再变化不一定平衡,故d错误。
保持不再变化不一定平衡,故d错误。
②根据![]() ,
, ![]() 0.0015 mol/(L·min),
0.0015 mol/(L·min), ![]() 0.003 mol/(L·min)。
0.003 mol/(L·min)。
③
![]() 4.5×106;
4.5×106;
④升高温度,溶液中AsO43-的平衡转化率减小,说明平衡逆向移动,正反应放热,ΔH < 0。
(3)②淀粉遇碘变蓝色,指示剂为淀粉。
设As2O3的质量为xg
根据AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O可知,
AsO33-(无色)+I2(浅黄色)+H2O可知,
![]()
X=0.099g
As2O5的质量分数是![]() 50.50%
50.50%
(4)根据元素守恒As4S4在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为SO2,双氧水将As2O3氧化为H3AsO4,根据电子守恒化学方程式为2H2O2+H2O+As2O3=2H3AsO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.N2、CO2和SiO2都是由分子构成的物质,均存在共价键
B.相同条件下,H2O比H2S稳定是因为H2O分子中含有氢键
C.CH4和CCl4中,每个原子的最外层都具有8电子稳定结构
D.氯化钠是由钠离子和氯离子构成的离子晶体,加热熔化时需破坏离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.2 mol·L-1的NaCl溶液,说法不正确的是
A. 500mL该溶液中,所含溶质的质量为5.85g
B. 取2.34gNaCl固体,放入250mL容量瓶,加水配成200mL溶液
C. 从1L该溶液中取出100mL,则取出的NaCl的物质的量为0.02 mol
D. 取该溶液10mL,加水稀释至100mL后,NaCl的物质的量浓度为0.02 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F( )是合成某种药物的中间体,它的一种合成路线如下:
)是合成某种药物的中间体,它的一种合成路线如下:
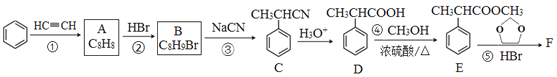
回答下列问题:
(1)A的结构简式为______,分子中处于同一平面的原子最多有____个。
(2)E中官能团名称是_____,①~④中属于加成反应的是_______(填序号)。
(3)反应③的化学方程式为______________。
(4)反应⑤的生成物有两种,除了F以外,另一种生成物的名称是______。
(5)满足下列条件的D的同分异构体有______种。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应; ③分子中有1个甲基
(6)仿照E的合成路线,设计一种由![]() 合成
合成![]() 的合成路线_________________。
的合成路线_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.碘酸钾是国家规定的食盐加碘剂B.无水乙醇常用于杀菌消毒
C.口服维生素C可以促进补铁剂吸收D.聚乙烯塑料制品可用于食品包装
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.化学反应的焓变与反应的途径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂保存或者盛放方法正确的是( )
A. 浓硝酸盛放在铜质器皿中 B. NaOH溶液保存在带橡胶塞的试剂瓶中
C. 稀硝酸盛放在铁质器皿中 D. 锌粒保存在细口玻璃瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com