
【题目】某温度时,CuS、MnS 在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 ( )
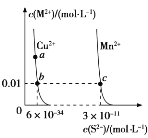
A.该温度下,Ksp(CuS)小于 Ksp(MnS)
B.a 点对应的 Ksp 等于 b 点对应的 Ksp
C.在含有 CuS 和 MnS 固体的溶液中 c(Mn2+)∶c(Cu2+)=2×10-23∶1
D.向 CuSO4 溶液中加入 MnS 发生如下反应:Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)
【答案】C
【解析】
由图象可知当c(M2+)相同时,CuS固体的溶液中c(S2-)较小,则说明Ksp(CuS)较小,图象中处于曲线上的点为平衡点,即饱和溶液,利用平衡移动的影响因素分析。
A. 由图象可知,当c(M2+)相同时,CuS固体的溶液中c(S2-)较小,则说明Ksp(CuS)较小,故A正确;
B. a、b处于同一温度下,Ksp相同,故B正确。
C. 由图象可知,在此温度下,在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=6×10-34:3×10-11=2×10-23:1,故C错误;
D. 因Ksp(CuS)小于Ksp(MnS),则向CuSO4溶液中加入MnS,可发生沉淀的转化,即Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),故D正确;
CuS(s)+Mn2+(aq),故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
KSCN溶液 | Ⅰ | i.先加1 mL 0.1 mol/L FeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后退色 |
Ⅱ | iii.先滴加1 mL 0.05 mol/L Fe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
(1)①用离子方程式表示实验I溶液变红的原因___________
②针对实验I中红色褪去的原因,小组同学认为是SCN被酸性KMnO4氧化为SO42,并设计如图实验装置证实了猜想是成立的。
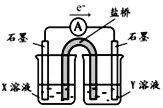
其中X溶液是_____________,检验产物SO42的操作及现象是__________。
(2)针对实验Ⅱ“红色明显变浅”,实验小组提出预测。
原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
原因②:SCN可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN![]() [Fe(SCN)]2+平衡左移,红色明显变浅。
[Fe(SCN)]2+平衡左移,红色明显变浅。
已知:Mg2+与SCN难络合,于是小组设计了如下实验:
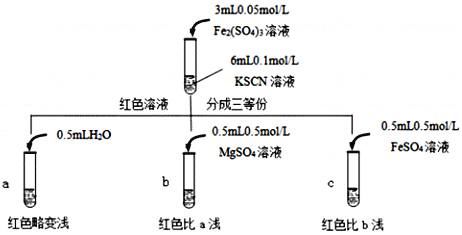
由此推测,实验Ⅱ“红色明显变浅”的原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 代替
代替![]() 与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。

燃烧器中反应①![]() (主反应)
(主反应)
反应②![]() (副反应)
(副反应)
再生器中反应:![]()
(1)气化反应器中发生反应的化学方程式是 ______。
(2)燃烧器中![]() 物质的量分数随温度T、压强p
物质的量分数随温度T、压强p![]() 的变化曲线见图,从图中可以得出三条主要规律:
的变化曲线见图,从图中可以得出三条主要规律:

①其他条件不变,温度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由图可知,为减少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)该燃烧技术中可循环的物质除![]() 、CaS外,还有 ______
、CaS外,还有 ______ ![]() 写名称
写名称![]() 。
。
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,完成以下实验装置图:______
中的CO,完成以下实验装置图:______![]() 注:
注:![]() 。
。

(5)CO2在自然界循环时可与![]() 反应,
反应,![]() 是一种难溶物质,其
是一种难溶物质,其![]() 。现将
。现将![]()
![]() 的
的![]() 溶液与一定浓度的
溶液与一定浓度的![]() 溶液等体积混合生成沉淀,计算应加入
溶液等体积混合生成沉淀,计算应加入![]() 溶液的最小浓度为 ______(保留二位有效数字)。
溶液的最小浓度为 ______(保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用如图所示装置测定中和热的实验步骤如下:
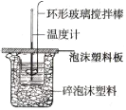
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合溶液最高温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是__。
(2)环形玻璃搅拌棒搅拌溶液的操作是__。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和H2SO4溶液代替NaOH溶液和盐酸,理由__。
(4)现将一定量的稀NaOH溶液、Ca(OH)2溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔΗ1、ΔΗ2、ΔΗ3,则ΔΗ1、ΔΗ2、ΔΗ3的大小关系为___。
II.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2–3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.02 | 20.00 |
2 | 0.10 | 20.00 | 20.00 |
3 | 0.10 | 19.00 | 20.00 |
4 | 0.10 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为___g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有___。
(2)根据上述数据,可计算出该盐酸的浓度为___(保留小数点后2位)。
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有__。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式:__MnO4-+__HSO3-+__H+=__
(2)用KMnO4进行滴定时,KMnO4溶液应装在___滴定管中(填酸式或碱式),判断滴定终点的现象是:滴入最后一滴KMnO4溶液时,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是__________________________(用化学方程式表示),所以他认为应该检验__________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_______。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用____________________________________。
(4)C装置中出现的现象是_______________________________________________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是有用的化工原料,回收利用
是有用的化工原料,回收利用![]() 既能减少大气污染,又能充分利用资源.有学者提出利用
既能减少大气污染,又能充分利用资源.有学者提出利用![]() 、
、![]() 等离子的作用,在常温下将
等离子的作用,在常温下将![]() 氧化成
氧化成![]() 而实现
而实现![]() 的回收利用.某研究性学习小组设计如图1下方案,在实验室条件下测定转化器的脱硫效率:
的回收利用.某研究性学习小组设计如图1下方案,在实验室条件下测定转化器的脱硫效率:
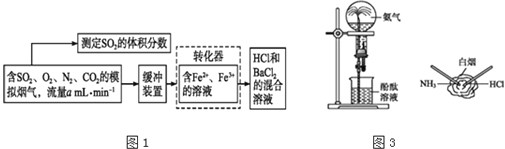
(1)写出![]() 将
将![]() 氧化成
氧化成![]() 的离子方程式______.
的离子方程式______.
(2)向滴有紫色石蕊溶液的试管中通入![]() 气体,现象是______,若再向其中滴入足量的氯水,现象是______,涉及反应的化学方程式有______.
气体,现象是______,若再向其中滴入足量的氯水,现象是______,涉及反应的化学方程式有______.
(3)图2甲是学过的验证铜与浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
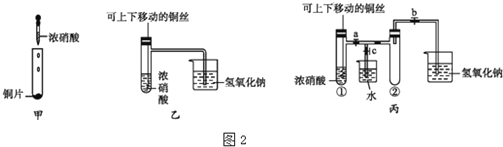
①甲、乙、丙3个装置中共同发生的反应的化学方程式是______,体现了浓硝酸的性质是______,往浅绿色的![]() 溶液中,逐滴加入稀盐酸时,溶液的颜色变化应是______
溶液中,逐滴加入稀盐酸时,溶液的颜色变化应是______
②和甲装置相比,乙装置的优点是______.
(4)图3所示是![]() 的两个性质实验,下列有关说法中正确的是______
的两个性质实验,下列有关说法中正确的是______
A.两个实验均表现了![]() 易溶于水
易溶于水
B.两个实验均表现了![]() 易挥发
易挥发
C.两个实验均表现了![]() 是碱性气体
是碱性气体
D.两个实验均表现了![]() 是还原性气体.
是还原性气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式(△H的绝对值均正确)书写正确的是 ( )
A.2CO(g)+O2(g)===2CO2(g); ![]() H=-566 kJ·mol-1(燃烧热)
H=-566 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l); ![]() H=+57.3 kJ·mol-1 (中和热)
H=+57.3 kJ·mol-1 (中和热)
C.C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l);![]() H=-1366.8 kJ·mol-1 (燃烧热)
H=-1366.8 kJ·mol-1 (燃烧热)
D.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l);![]() H=-114.6 kJ·mol-1 (中和热)
H=-114.6 kJ·mol-1 (中和热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B. 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-![]() HCOO-+NH4++2Ag↓+3NH3 +H2O
HCOO-+NH4++2Ag↓+3NH3 +H2O
C. 乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2 +OH-![]() Cu2O↓+CH3COO-+3H2O
Cu2O↓+CH3COO-+3H2O
D. 向小苏打溶液中加入醋酸:CO32-+2CH3CHOOH=CO2+H2O+2CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应: A(s)+3B(g)![]() 2C(g)+D(g)已达平衡状态的是
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强B. 混合气体的密度
C. 3v逆(C)=2v正(B)D. 气体的平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com