

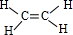
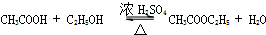 .
. 分析 B和D反应生成乙酸乙酯,B氧化生成C,C氧化生成D,故B为乙醇,C为乙醛,D为乙酸,A与水反应生成乙醇,故A为乙烯,据此解答.
解答 解:B和D反应生成乙酸乙酯,B氧化生成C,C氧化生成D,故B为乙醇,C为乙醛,D为乙酸,A与水反应生成乙醇,故A为乙烯.
(1)A是乙烯,结构式为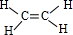 ,故答案为:
,故答案为: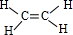 ;
;
(2)A→B是乙烯与水发生加成反应生成乙醇,故答案为:加成反应;
(3)乙酸的水溶液与氢氧化钠反应生成乙酸钠与水,反应离子方程式为:CH3COOH+OH-=CH3COO-+H2O,
故答案为:CH3COOH+OH-=CH3COO-+H2O;
(4)乙醇与钠反应生成乙醇钠与氢气,反应方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(5)B→C的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(6)反应④是乙醇与乙酸反应生成乙酸乙酯,反应反应方程式为: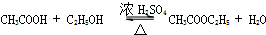 ,
,
故答案为: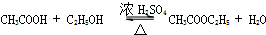 .
.
点评 本题考查有机物的推断,涉及烯烃、醇、醛、羧酸的性质与转化,试题旨在考查学生对有机化学基础的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 原电池中发生氧化反应的是负极 | |
| C. | 电解池是将化学能转化为电能的装置 | |
| D. | 电解池中发生氧化反应的是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 此烃名称为4-甲基-1-戊炔.
此烃名称为4-甲基-1-戊炔. 的烃可命名为1-甲基-3-乙基苯.
的烃可命名为1-甲基-3-乙基苯. 的烃可命名为:2,4-二甲基-3-乙基戊烷.
的烃可命名为:2,4-二甲基-3-乙基戊烷. 的键线式:
的键线式: .
. 的键线式:
的键线式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
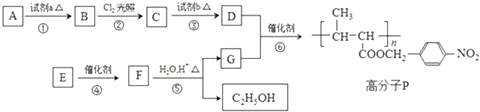
 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$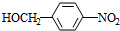 +NaCl.
+NaCl.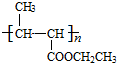 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$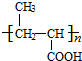 +n CH3CH2OH.
+n CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
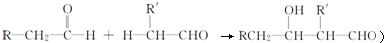 )
)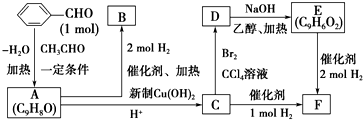
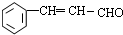 、
、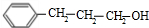 、
、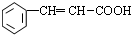 、
、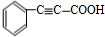 、
、 .
.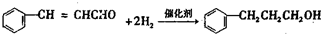 ;
;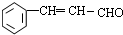 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$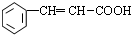 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com