
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为nA | |
| B. | 1 mol Na2O2固体中含阴离子总数为2nA | |
| C. | 5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 nA | |
| D. | 100 mL 12mol•L-1 浓盐酸与足量MnO2加热反应,转移电子数为1.2nA |
分析 A、溶液体积不明确;
B、过氧化钠由2个Na+和1个O22-构成;
C、在质量分数为46%的乙醇溶液中,乙醇中含有氧原子,水中也含氧原子;
D、MnO2只与浓盐酸反应,与稀盐酸不反应.
解答 解:A、溶液体积不明确,故镁离子的个数无法计算,故A错误;
B、过氧化钠由2个Na+和1个O22-构成,故1mol过氧化钠中含2molNa+和1molO22-,即含1mol阴离子,即1nA个,故B错误;
C、乙醇溶液中,水的物质的量是0.15mol,氢原子0.3mol;乙醇的物质的量是0.05mol,氢原子0.3mol,故氢原子的总数为0.6NA,故C正确;
D、MnO2只与浓盐酸反应,与稀盐酸不反应,浓盐酸的物质的量是1.2mol,完全反应生成氯气0.3mol,由于浓盐酸变成稀盐酸,不能继续反应,即盐酸会有剩余,故生成的氯气小于0.3mol,转移电子数小于0.6NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 参加反应的物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 在给定条件下,当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| D. | 不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
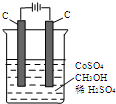 电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:
电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③的熔点低于⑥的熔点 | |
| B. | 元素①与元素⑥形成的化合物皆为碱性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:⑤>⑦>④ | |
| D. | 元素④形成的氯化物中所有原子周围都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容量瓶、分液漏斗、滴定管在使用前都需要检查是否漏水,可以用相同的实验方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的$\frac{1}{2}$ | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 将灼烧后的海带灰加水煮沸2-3分钟的目的是加快碘化物在水中的溶解,使灰烬中的碘离子尽可能多的进入溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10的二氯取代物有4种 | |
| B. | 最简式为C2H5的烃结构简式有5种 | |
| C. | 乙苯的一氯取代物只有3种 | |
| D. | 分子式为C4H10O且与钠反应的有机物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com