



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʡ�����и�����ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��������10������:
��NaHCO3����NH4HCO3����BaSO4����HF����C2H5OH����Al����ʳ��ˮ����CH3COOH�� ��HCl�� ��NaOH��
��1���������ڷǵ���ʵ���_____________������ţ���ͬ�������ܸ����ᷴӦ���ܸ�NaOH��Һ��Ӧ����_____________��
��2��NaHCO3��Һ�� �ԣ���ᡱ��������С�����ԭ���ǣ�������ӷ���ʽ��ʾ��
��
��3������ʱ��������Һ����pH=4��CH3COOH��Һ����pH=4��HCl��Һ����pH=10��NaOH��Һ������pH=10��CH3COONa��Һ������֪����ʱ����ĵ��볣��Ϊ1.75��10��5��
�����й�������ȷ���� ����������Һ���ʱ������仯��
| A������Һ�ֱ���10g���۳�ַ�Ӧ������H2������һ������ |
| B�������������Ϻ���Һ�е�c(CH3COO��)Ϊԭ��ҺŨ�ȵ�1/2 |
| C������͢�������Ϻ���ҺpHһ��С��7 |
| D��������Һ��10mL�ֱ��ˮϡ����100mL����Һ��pH����>��>��>�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������и�����ҵ��������һ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������£�N2H4���ǵ������ֳ���������ڿ�ѧ����������������Ҫ��Ӧ�á�
��.��1��N2H4�е�Nԭ�������ﵽ8�����ȶ��ṹ��д��N2H4�Ľṹʽ_____________��
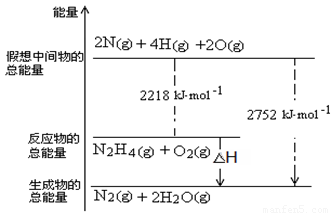
��2��NH3��NaClO��Ӧ�ɵõ��£�N2H4�����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3������һ�ָ���ȼ�ϣ��йػ�ѧ��Ӧ�������仯����ͼ��ʾ��д����ȼ�յ��Ȼ�ѧ����ʽ ��
��.���ĺϳ�������Ҫ�Ļ�������֮һ����֪��
N2��g����3H2��g�� 2NH3��g����H����92.4 kJ��mol��1
2NH3��g����H����92.4 kJ��mol��1
��3�������Ϊ2L���ܱ������У�����ͬ���¶��£�ʹ����ͬ�Ĵ����ϳɰ���ʵ���÷�Ӧ����ʼ���ﵽƽ��ʱ���й��������±���ʾ��

�Իش�
��1�����и�����˵���÷�Ӧ�Ѵﵽƽ��״̬����______________����д�����ĸ����
a��������N2��H2��NH3��Ũ��֮��Ϊ1�U3�U2
b��v��N2������3v��H2����
c��������ѹǿ���ֲ���
d�����������ܶȱ��ֲ���
��2�������ϱ����ݣ����й�ϵ��ȷ����_________����д�����ĸ����
A��2c1��1.5mol��L-1 B��w3=w1 C��2��1=��2 D��K��= K��= K��
��3���������з�Ӧ�ӿ�ʼ����ƽ��ƽ������Ϊv(H2)= _____________��
III.ֱ�ӹ���ʽ����ȼ�ϵ�صĵ�ط�Ӧʽ��4NH3+3O2=2N2+6H2O���������Һһ��ʹ��KOH��Һ�����缫��Ӧʽ��__________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ�����и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��������10������:
��NaHCO3����NH4HCO3����BaSO4����HF����C2H5OH����Al����ʳ��ˮ����CH3COOH�� ��HCl�� ��NaOH��
��1���������ڷǵ���ʵ���_____________������ţ���ͬ�������ܸ����ᷴӦ���ܸ�NaOH��Һ��Ӧ����_____________��
��2��NaHCO3��Һ�� �ԣ���ᡱ��������С�����ԭ���ǣ�������ӷ���ʽ��ʾ��
��
��3������ʱ��������Һ����pH=4��CH3COOH��Һ����pH=4��HCl��Һ����pH=10��NaOH��Һ������pH=10��CH3COONa��Һ������֪����ʱ����ĵ��볣��Ϊ1.75��10��5��
�����й�������ȷ���� ����������Һ���ʱ������仯��
A������Һ�ֱ���10g���۳�ַ�Ӧ������H2������һ������
B�������������Ϻ���Һ�е�c(CH3COO��)Ϊԭ��ҺŨ�ȵ�1/2
C������͢�������Ϻ���ҺpHһ��С��7
D��������Һ��10mL�ֱ��ˮϡ����100mL����Һ��pH����>��>��>��
��4������ʱijHCl��Һ����ˮ�������C��H+����1��10��amol/L������ͬpH��AlCl3��Һ����ˮ�������C��H+����1��10��bmol/L (��֪a, b��ΪС��14��������)����a��b֮������Ĺ�ϵΪ �� ����һ����ʽ��һ������ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ�꽭��ʡ�����и���������ģ�⿼�ԣ����ۣ���ѧ���� ���ͣ������
A��B��C��D�Ƕ�����Ԫ���γɵ��������嵥�ʣ���������Ϊ�����H����Ϊ��ͨп�̸ɵ�صĵ���ʡ��йص�ת����ϵ����ͼ��ʾ����Ӧ����������ȥ����
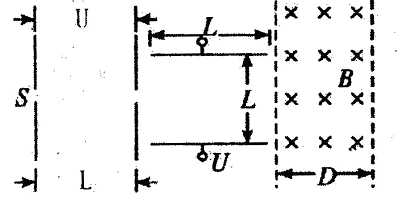
��ش��������⣺
��1��B�ĽṹʽΪ____ ��G�Ļ�ѧʽΪ ��
��2��Y��E��һ�������¿ɷ�Ӧ����B��Z���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3�������Ϊ0.5L�ĺ����ܱ������У�����1.25molB��1.25molD�������»�ѧ��Ӧ��
B��g��+3D��g��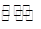 2Y��g�����仯ѧƽ�ⳣ��K��T�Ĺ�ϵ���±���ʾ��
2Y��g�����仯ѧƽ�ⳣ��K��T�Ĺ�ϵ���±���ʾ��
|
T/�� |
300 |
400 |
|
K |
3.41 |
0.50 |
������Ӧ��400���½��У����и���������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���ݵ���
������ĸ����
A��Y��B��D�����ʵ����ֱ�Ϊ0.50mol��l.0mol��0.50mol
B��v����B��= 3v ����D��
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
����һ��������B��g��+3D��g��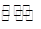 2Y��g���ﵽƽ��״̬��ʱ��Ϊt1ʱ�ı���������ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ������˵������ȷ���ǣ� ��
2Y��g���ﵽƽ��״̬��ʱ��Ϊt1ʱ�ı���������ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ������˵������ȷ���ǣ� ��
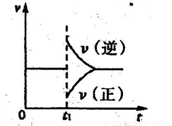
A��ά���¶ȡ���Ӧ��ϵ������䣬t1ʱ����Y��g��
B��ά��ѹǿ���䣬tlʱ���߷�Ӧ��ϵ�¶�
C��ά���¶Ȳ��䣬t1ʱ����Ӧ��ϵ���
D��ά���¶ȡ�ѹǿ���䣬t1ʱ����Y��g��
��4��0.lmol��L-1��X��Һ��0.2mol��L-1��Y��Һ�������Ϻ��Լ��ԣ���û����Һ�и�����Ũ�ȴ�С˳���� ��
��5�������£�0.1mol��L-1��Y��Һ��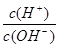 =l��10-8�����������д������ �� ��
=l��10-8���������������� �� ��
A������Һ��pH=11
B������Һ�е����ʵ������������Ũ��Ϊ0.1mol��L-1
C������Һ��ˮ�������c��H+����c��OH�����˻�Ϊl��10-22
D��pH=l��X��ҺV1L��0.1mol��L-1��Y��ҺV2L��ϣ��������ҺpH =7����V1<V2
E����0.1mol��L-1��Y��Һ��ˮϡ��100����pH >9
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com