
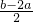
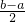
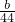 mol,结合氢氧化钡的物质的量,根据氢氧根离子守恒计算原溶液中n(NaOH),据此计算解答.
mol,结合氢氧化钡的物质的量,根据氢氧根离子守恒计算原溶液中n(NaOH),据此计算解答.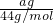 =
=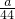 mol,根据碳原子守恒有n(BaCO3)=n(CO2)=
mol,根据碳原子守恒有n(BaCO3)=n(CO2)=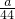 mol,根据钡离子守恒有n[Ba(OH)2]=n(BaCO3)=
mol,根据钡离子守恒有n[Ba(OH)2]=n(BaCO3)=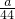 mol,
mol,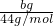 =
=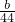 mol,溶液中n(HCO3-)等于原溶液中n(OH-),故溶液中n(OH-)=
mol,溶液中n(HCO3-)等于原溶液中n(OH-),故溶液中n(OH-)=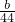 mol,所以原溶液中n(NaOH)=
mol,所以原溶液中n(NaOH)=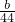 mol-2×
mol-2×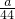 mol=
mol=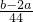 mol,
mol,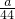 mol:
mol: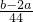 mol=a:(b-2a),
mol=a:(b-2a),

 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一氢氧化钡和氢氧化钠的混合溶液,往溶液中持续不断缓慢通入CO2气体,当通入a g CO2时生成的沉淀量达到最大值,当通入b g CO2时沉淀恰好完全溶解,则原溶液中氢氧化钡与氢氧化钠的物质的量浓度之比为
A.a︰(b-a) B.a︰(b-2a) C.a︰ D.a︰
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市浦东新区高三下学期4月质量抽测化学试卷(解析版) 题型:选择题
现有一氢氧化钡和氢氧化钠的混合溶液,往溶液中持续不断缓慢通入CO2气体,当通入a g CO2时生成的沉淀量达到最大值,当通入b g CO2时沉淀恰好完全溶解,则原溶液中氢氧化钡与氢氧化钠的物质的量浓度之比为
A.a︰(b-a) B.a︰(b-2a) C.a︰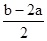 D.a︰
D.a︰
查看答案和解析>>
科目:高中化学 来源:2012年上海市浦东新区高考化学二模试卷(解析版) 题型:选择题
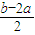
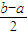
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com