
分析 (1)a保持容积不变,b保持内外压强相等,反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,平衡时a中压强比b中小,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡;
(2)改变起始投料比,要想达到平衡后a中C的浓度仍为N mol•L-1,恒温恒容下,与原平衡是完全等效平衡,按化学计量数转化到方程式左边,满足与原平衡中相同物质的起始投料量相等;
b中C的浓度为n mol•L-1,与原平衡为等效平衡,等温等压的条件下,按化学计量数转化到方程式左边,满足与原平衡中物质的投料量比.
解答 解:(1)a保持容积不变,b保持内外压强相等,反应3A(g)+B(g)?2C(g)+D(g)是气体物质的量减少的反应,平衡时a中压强比b中小,故b相当于在a平衡的基础上加压,平衡右移,平衡移动不能消除A的浓度增大,到达新平衡时的浓度高于原平衡,故b中平衡时A的浓度大于a中A的平衡浓度,即M<m,平衡右移,b中C的平衡浓度高于a中C的平衡浓度,即N<n,
故答案为:<;<;
(2)改变起始投料比,要想达到平衡后a中C的浓度仍为N mol•L-1,恒温恒容下,与原平衡是完全等效平衡,按化学计量数转化到方程式左边,满足与原平衡中相同物质的起始投料量相等,选项中DE符合;
b中C的浓度为n mol•L-1,与原平衡为等效平衡,等温等压的条件下,按化学计量数转化到方程式左边,满足与原平衡中物质的投料量比,选项中AD符合,
故答案为:D;AD.
点评 本题考查化学平衡移动与计算,难度中等,注意利用等效思想设计平衡建立的途径,理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3CH2CH2CH2CH3 | C. | 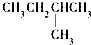 | D. | 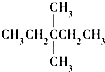 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
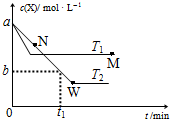 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•L--1•min--1 | |
| C. | M点时再加入一定量X,平衡后X的转化率减小 | |
| D. | 该反应进行到M点放出的热量小于进行到W点放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |
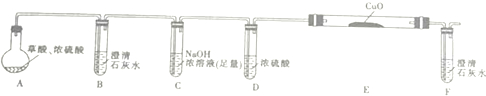
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应AlCl3+4NaOH═NaAlO2+3NaCl+2H2O,可以设计成原电池 | |
| B. | Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率 | |
| C. | 把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化 | |
| D. | Zn-Cu原电池工作过程中,溶液中H+向负极作定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O和CS2分子中的原子都达到了稳定结构.
H2O和CS2分子中的原子都达到了稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(SO42-)为0.1mol/L | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | K+可能存在 | D. | Ba2+一定不存在,Ca2+可能存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com