
A��B��C��D��E��Ϊ������Ԫ�أ�A�����ԭ��������С��Ԫ�أ�B�ģ�1�������Ӻ�C�ĨD1�������Ӷ�����ԭ�Ӿ�����ͬ�ĵ��Ӳ�ṹ��D��C����һ���ڣ�����B�γ�BD�����ӻ����E��CΪͬһ����Ԫ�أ�������������Ӧ��ˮ����Ϊһ��ǿ�ᡣ�����������Ϣ�ش��������⡣
(1)BԪ����Ԫ�����ڱ��е�λ����____________��
(2)����DԪ�ص�ԭ�ӽṹʾ��ͼ____________��
(3)��E���⻯�������������������ȵķ�����____________(��һ�����ѧʽ����ͬ)��������____________��
(4)A��C�γɵĻ������к��л�ѧ����������____________��
(5)D�ĵ�����B������������Ӧ��ˮ�������Һ������Ӧ�����ӷ���ʽΪ__________________________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ������Ũ�ȴ�С��ϵ�������
A.0.1 mol ��NH4Cl��Һ�У�
��NH4Cl��Һ�У�
B. 0.1 mol ��CH3COONa��Һ�У�
��CH3COONa��Һ�У�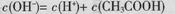
C. 0.1 mol ����Һ�У�
����Һ�У�
D.pH=2��������pH=12�İ�ˮ�������Ϻ�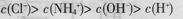
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ݵ���������Ӧ���Ȼ�ѧ����ʽ
(ⅰ)I2(g)��H2(g)2HI(g)����H����9.48 kJ·mol��1
(ⅱ)I2(s)��H2(g)2HI(g)����H��26.48 kJ·mol��1
�����ж���ȷ���� (����)
A��1 mol I2(s)��ͨ��2 g H2(g)����Ӧ����26.48 kJ
B��1 mol��̬����1 mol��̬���������������17.00 kJ
C����Ӧ(ⅱ)�ķ�Ӧ���������ȷ�Ӧ(ⅰ)�ķ�Ӧ����������
D����Ӧ(ⅰ)�ų��������࣬���Բ���������ͣ��ȷ�Ӧ(ⅱ)�IJ�����ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ĸ��������ڲ�ͬ�����²���ĺϳɰ���Ӧ�����ʣ����������( )
A��V(H2)==0.1 mol��(L��min) B��V(N2)==0.1mol��(L��min)
C��V(NH3)==0.15mol��(L��min) D�� V(N2)==0.002mol��(L��s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и��������У����ܷ���ˮ�ⷴӦ����( )
A�������ʺͰ����� B����֬�͵�����
C����ά�غ������� D�����ۺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2����ϩ�Ľṹ��ʽ��ȷ���� �� ��
A��CH2��CHCH2CH3 B��CH3CH��CHCH3 C��CH2��CHCH��CH2 D��CH2��C��CHCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
BeCl2�۵�ϵͣ������������ڴ����ѣ��仯ѧ������AlCl3���ơ��ɴ˿��Ʋ�BeCl2
A������̬������ B��ˮ��Һ������
C���۵��BeBr2�� D����������������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2 (g)��CH4(g)
(g)��CH4(g) 2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 |
|
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
����֪��I��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H1
II��CO(g)��H2O (g)��CO2(g)��H2 (g) ��H2 
III��2CO(g)��O2(g)��2CO2(g) ��H3
��ӦCO2(g)��CH4(g) 2CO(g)��2H2(g) �ġ�H= ���á�H1 ��H2 ��H3��ʾ����
2CO(g)��2H2(g) �ġ�H= ���á�H1 ��H2 ��H3��ʾ����
�۶�������ӦII��CO(g) + H2O(g)  CO2 (g)+ H2(g) ��H 2 = −41 kJ/mol����ʼʱ���ܱ������г���1.00 molCO �� 1.00 molH2O���ֱ��������ʵ�飬̽��Ӱ��ƽ������أ�����������ͬ�Ҳ������κθ� ��Ӧ��Ӱ�죩��ʵ���������±���
CO2 (g)+ H2(g) ��H 2 = −41 kJ/mol����ʼʱ���ܱ������г���1.00 molCO �� 1.00 molH2O���ֱ��������ʵ�飬̽��Ӱ��ƽ������أ�����������ͬ�Ҳ������κθ� ��Ӧ��Ӱ�죩��ʵ���������±���
��ʵ����c(CO2)��ʱ��仯�Ĺ�ϵ����ͼ�����ڴ���Ŀ�ͼ�У��ֱ� ��ʵ��ں͢���c(CO2)��ʱ��仯��ϵ��Ԥ�ڽ��ʾ��ͼ��
��ʵ��ں͢���c(CO2)��ʱ��仯��ϵ��Ԥ�ڽ��ʾ��ͼ��

 ��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч����������� ����������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ���� ��
����������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ���� ��
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
 ��3���Լ״�Ϊȼ�ϵ����͵�أ���ɱ�����������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ���ش��������⣺
��3���Լ״�Ϊȼ�ϵ����͵�أ���ɱ�����������Ϊȼ�ϵĴ�ͳȼ�ϵ�أ�Ŀǰ�õ��㷺���о�����ͼ��Ŀǰ�о��϶��һ�����������ȼ�ϵ�ع���ԭ��ʾ��ͼ���ش��������⣺
��B���ĵ缫��ӦʽΪ ��
�����ø�ȼ�ϵ������Դ����ʯī���缫�������ͭ��Һ������·��ת��1mole�� ʱ��ʵ�������ĵļ״��������������ϴ���ԭ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com