

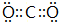 ��
������ X��Y��Z��W���ֻ�������ɶ�����Ԫ����ɣ�X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��˵��X��Y��Z�ж�����NaԪ�أ�WΪ��ɫ��ζ���壬����X��������Ԫ�أ����ܺͺ���Na�����ʷ�Ӧ����Z��Z�ܷ�Ӧ������ɫ���壬��XΪNaHCO3��YΪNaOH��ZΪNa2CO3��WΪCO2��
��1��W�Ƕ�����̼��������̼������̼ԭ�Ӻ�ÿ��Oԭ���γ��������õ��Ӷԣ�
��2��X��̼�����ơ�Y���������ƣ����߷�Ӧ����̼���ƺ�ˮ��
��3��NaHCO3���е�����Ԫ��֮�䣨���֡����ֻ����֣�����ɶ��ֻ��������װ�â���Ba��OH��2������Һ������ɫ��������ͼʾ��װ��I�����е����ʾ�Ϊ���壬�Ʋ�װ��I�е�����ΪNaHCO3��Na2CO3���壬��Ϊװ�â����ռ���һ����ɫ���壬˵��װ��I�в�����CO2��װ�â��е����ʷ�Ӧ��������һ����ɫ���壬�����Ʋ��װ�â��е�����ΪNa2O2��װ�â����ռ���������O2��
��װ�â��з�ӦΪ̼���ƻ�̼��������ϡ����ķ�Ӧ��
װ�â��������ǹ������ƣ�
����X���е�����Ԫ���е�������ɵ�ij������ڴ����������Ʊ����ռ����������װ�â������壬�û�������˫��ˮ��IΪ����װ�ã������и���������ռ���
��4����Z��Һ��ͨ�����������Ƶ�ij�������������г��õ�Ư�ס�����������NaCl��ͬʱ��̼���������ɣ�
��� �⣺X��Y��Z��W���ֻ�������ɶ�����Ԫ����ɣ�X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��˵��X��Y��Z�ж�����NaԪ�أ�WΪ��ɫ��ζ���壬����X��������Ԫ�أ����ܺͺ���Na�����ʷ�Ӧ����Z��Z�ܷ�Ӧ������ɫ���壬��XΪNaHCO3��YΪNaOH��ZΪNa2CO3��WΪCO2��
��1��WΪCO2������ʽΪ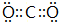 ���ʴ�Ϊ��
���ʴ�Ϊ��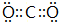 ��
��
��2��̼���������������Ƶ���Һ��Ӧ����̼���ƺ�ˮ�����ӷ���ʽΪHCO3-+OH-�TCO32-+H2O���ʴ�Ϊ��HCO3-+OH-�TCO32-+H2O��
��3��NaHCO3���е�����Ԫ��֮�䣨���֡����ֻ����֣�����ɶ��ֻ��������װ�â���Ba��OH��2������Һ������ɫ��������ͼʾ��װ��I�����е����ʾ�Ϊ���壬�Ʋ�װ��I�е�����ΪNaHCO3��Na2CO3���壬��Ϊװ�â����ռ���һ����ɫ���壬˵��װ��I�в�����CO2��װ�â��е����ʷ�Ӧ��������һ����ɫ���壬�����Ʋ��װ�â��е�����ΪNa2O2��װ�â����ռ���������O2��
��װ�â��з�Ӧ�Ļ�ѧ����ʽ��Na2CO3+H2SO4=Na2SO4+CO2��+H2O��2NaHCO3+H2SO4=Na2SO4+2CO2��+2H2O��װ�â������ʵĻ�ѧʽΪNa2O2��
�ʴ�Ϊ��Na2CO3+H2SO4=Na2SO4+CO2��+H2O��2NaHCO3+H2SO4=Na2SO4+2CO2��+2H2O��Na2O2��
��O2����ȡҲ������2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2���Ʊ���IΪ����װ�ã������и���������ռ���
�ʴ�Ϊ��H2O2����������
��4����Cl2ͨ��Na2CO3��Һ�У��Ƶ�ij�������������г��õ�Ư�ס����������ʣ�ͬʱ��NaHCO3���ɣ�˵�����ֲ���ΪNaClO��NaHCO3������IJ���ɸ���Ԫ���غ�ó�������ƽ��Ӧ�Ļ�ѧ����ʽΪ��2Na2CO3+C12+H2O=NaClO+NaCl+2NaHCO3��
�ʴ�Ϊ��2Na2CO3+C12+H2O=NaClO+NaCl+2NaHCO3��
���� ���⿼�������ƶϣ��漰��Ԫ�ػ�������ת����Ҫ��ѧ����Ԫ�ػ��ϵ�֪ʶ�dz����������ճ���������Ʊ�������ע�⣨4���з�Ӧ����ɷ֣���Ŀ�Ѷ��еȣ�


 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢܢ� | B�� | �ۢݢ� | C�� | �٢ڢ� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �� | �� | �� | |
| �ݻ� | 1L | 1L | 0.5L |
| ��ʼ�������� | X��2mol��Y��1mol | Z��2mol | X��0.5mol��Y��0.25mol |
| ƽ��ʱ | c��Z��=1.2mol•L-1 | c��Z��=1.2mol•L-1 |
| A�� | T��ʱ�÷�Ӧ��ƽ�ⳣ��KΪ3.75 | |
| B�� | ƽ��ʱ��Xת���ʣ��ף��� | |
| C�� | �����Ǿ�����������ƽ��ʱ��c��Z����1.2mol•L-1 | |
| D�� | ǰ2min�ڣ�����������X��ʾ��ƽ����Ӧ����v��X��=0.6mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȡ� | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��ijѧ����0.2000mol•L-1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
��ijѧ����0.2000mol•L-1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com