
要防止水体污染,改善水质,最根本的措施是 ( )。
A.控制工业废水的排放
B.对河水进行消毒处理
C.控制农田排水
D.减少用水量
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置。

Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:_________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象_______________ ______________________________________________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是_________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是________(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是____________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:______________________ _________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应无论怎样调整反应物的用量都只能生成一种物质的是( )
A.甲烷和氯气混合后光照发生反应 B.乙烯与氯化氢的加成反应
C.甲苯与等物质的量的Br2发生反应 D.乙炔和氯气的加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr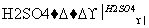 C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·mL-1);36 mL 浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题:
(1)该实验应选择下图中的a装置还是b装置________。
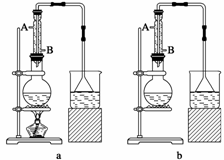
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL
C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是( )
A.A进B出 B.B进A出
C.从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中a为生铁,A烧杯中放入苯,B烧杯中为1 mol·L-1的稀硫酸,C烧杯中为海水。
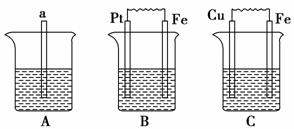
(1)B中Pt极的电极反应式为________。
(2)C中Cu极的电极反应式为________,Cu极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(4)要使B中的铁难被腐蚀,可将B中的稀硫酸改为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液中离子关系的说法正确的是( )
A.0.1 mol·L-1NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O等体积混合后离子浓度关系:c(Cl-)>c(NH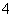 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应
NO2(g)+CO(g) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是
A. 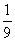 B.
B. 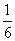 C.
C. 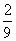 D.
D. 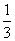
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com