
����Ŀ������ѧ�Dѡ��3�����ʽṹ�����ʡ�����Se����һ���п��������������õ�Ԫ�أ������γɶ��ֻ����
��1����̬��ԭ�ӵļ۲�����Ų�ͼΪ___________��
��2���ࡢ�顢���ĵ�һ�����ܴ�С����Ϊ_____________������Ԫ�ط��ű�ʾ��
��3��SeO32-������ԭ���ӻ�������___________��SeO32-�����幹����_____________����SeO32-��Ϊ�ȵ���ķ����У�дһ�����ʵĻ�ѧʽ���ɣ�_____________��
��4��H2Se����___________������Ի�Ǽ��ԣ����ӣ��Ƚ�H2O��H2Se�ķе�ߵͣ�H2O_________H2Se������>����<������=��������ԭ����_____________�����������۵�Ϊ217�� ��������____________���塣
��5������п��һ����Ҫ�İ뵼����ϣ��侧���ṹ��ͼ��ʾ���þ�������ԭ�ӵ���λ��Ϊ_________�����þ����ܶ�Ϊpg��cm-3������п��Ħ������ΪMg/mol��NA���������ӵ�������������aΪ_______pm��

���𰸡���1��![]() ����2��As>Se>Ge��
����2��As>Se>Ge��
��3��sp3����������1�֣���CCl4����SiF4����1�֣���
��4�����ԣ�1�֣���>��1�֣���ˮ����֮���������1�֣������ӣ�1�֣���
��5��4��1�֣���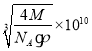
��������
�����������1����Ϊ34��Ԫ�أ���6���۵��ӣ��������ļ۲�����Ų�ʽΪ4s24p4���۲�����Ų�ͼΪ![]() ��
��
��2��ͬһ�����У�Ԫ�صĵ�һ����������ԭ��������������������ƣ����ڢ�A��Ԫ�ص�һ�����ܴ�������Ԫ�أ�����Ge��As��Se����Ԫ�صĵ�һ�����ܵĴ�С˳���ǣ�As��Se��Ge��
��3��SeO32-������ԭ�ӵļ۲���Ӷ���Ϊ![]() ����6+2��=4������Se�ӻ���ʽΪsp3�ӻ���SeO32-������ԭ��Se�ļ۲���Ӷ���Ϊ
����6+2��=4������Se�ӻ���ʽΪsp3�ӻ���SeO32-������ԭ��Se�ļ۲���Ӷ���Ϊ![]() ����6+2��=4����������һ���µ��Ӷԣ�����SeO32-�����幹���������Σ��ȵ�������ָ�۵��Ӻ�ԭ��������ȵ�������SeO42-��Ϊ�ȵ���ķ�����CCl4����SiF4����
����6+2��=4����������һ���µ��Ӷԣ�����SeO32-�����幹���������Σ��ȵ�������ָ�۵��Ӻ�ԭ��������ȵ�������SeO42-��Ϊ�ȵ���ķ�����CCl4����SiF4����
��4��H2Se�������йµ��Ӷԣ�����H2Se���ڼ��Է�����ˮ���Ӽ�������������ˮ�ķе����H2Se�ķе������������۵�Ϊ217�� ����������ڷ��Ӿ��壻
��5����������п�����ṹͼ��֪��ÿ��пԭ����Χ��4����ԭ�ӣ�ÿ����ԭ����ΧҲ��4��пԭ�ӣ�������ԭ�ӵ���λ��Ϊ4���þ����к�����ԭ����Ϊ8��![]() +6��
+6��![]() =4������пԭ����Ϊ4�����ݦѣ�
=4������пԭ����Ϊ4�����ݦѣ�![]() =
=![]() ������V=
������V=![]() �����ı߳�Ϊ
�����ı߳�Ϊ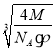 cm=
cm=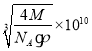 pm��
pm��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ1��ʾһЩ�����е�ijЩ�ṹ�����Ƿֱ����Ȼ��ơ��Ȼ�嵐��ɱ������ʯ��ʯī�ṹ�е�ijһ�ֵ�ijһ���֣��ڵ�ɱ�ʾ��ͬ����ͬ�����ӣ���

��1�����д������ʯ���� ��������ĸ����ͬ�������ʯ��ÿ��̼ԭ���� ��̼ԭ����ӽ��Ҿ�����ȣ�
��2�����д���ʯī���� ������ÿ����������ռ�е�̼ԭ����ƽ��Ϊ ����
��3�����б�ʾ�Ȼ��Ƶ��� ��ÿ����������Χ������ӽ��Ҿ�����ȵ��������� ����
��4�������Ȼ�蘆��� ��ÿ��������� �������ӽ��ڣ�
��5�������ɱ����� ��ÿ��������̼������ ��������̼���ӽ��ڣ�
��6����Mg��C��Ni����Ԫ���γɵ�һ�־��г����Եľ��壬������ͼ2��ʾ��Mgλ��C��Niԭ�ӽ��ܶѻ����γɵĿ�϶���У���һ��Niԭ�Ӿ��������Niԭ�ӵ���ĿΪ ���þ���Ļ�ѧʽΪ �����þ������Է�������ΪM�������ӵ�����ΪNA��Mg��C��Ni����Ԫ�ص�ԭ�Ӱ뾶�ֱ�Ϊr1pm��r2pm��r3pm����þ�����ܶȱ���ʽΪ gcm��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl�Ǻ�ˮ����ȡ������һ����Ҫ���ʣ���ʳ���⣬������һ�ֹ�ҵԭ�ϣ�������NaClΪԭ�ϵIJ�Ʒ��
���ռ� ������ �������� ������ ������
A���٢ڢۢܢ� B�����٢ڢۢ� C�����٢ۢܢ� D�����٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A+B![]() 3C+4D��Ӧ�У���ʾ�÷�Ӧ���������� �� ��
3C+4D��Ӧ�У���ʾ�÷�Ӧ���������� �� ��
A��VA==0.5 mol/��Ls�� B�� VB==0.3 mol/��Ls��
C��VC==4.8 mol/��Lmin�� D�� VD==1 mol/��Ls��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.9gNa2O2����100mLˮ�У���ַ�Ӧ���㣺
��1������O2���������״������
��2����Ӧ������NaOH�����ʵ���Ũ�ȣ���Ӧǰ����Һ����仯���Բ��ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڢ���ϩ���ڱ������Ҵ��������ᡢ�������ǵ��л������������ȷ����( )
A�����������Ƶ�Cu(OH)2����Һ����ۢܢ�
B��ֻ�Т٢ۢ���ʹ����KMnO4��Һ��ɫ
C��ֻ�Тڢۢ��ܷ���ȡ����Ӧ
D��һ�������£��ݿ���ת��Ϊ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�� | Ԫ�����ʻ�ԭ�ӵĽṹ |
T | 2p����ܼ���������s�ܼ���������1�� |
X | L��p�ܼ���������s�ܼ���������2�� |
Y | ��������Ԫ�صļ������а뾶��С |
Z | L����3��δ�ɶԵ��� |
��1��д��Ԫ��X�����ӽṹʾ��ͼ�� ��д��Ԫ��Z�ļ���̬�⻯��ĵ���ʽ�� ��
��2��д��Ԫ��Y������������Ӧ��ˮ������KOH��Ӧ�Ļ�ѧ����ʽ�� ��
��3��T��Y��Z����Ԫ�صĵ����л�ѧ�������Բ�ͬ���������ʵ��� ����Ԫ�ط��ţ���ͬ����Ԫ��T���Ȼ�����ȣ��ǽ����Խ�ǿ���� �����б�������֤����һ��ʵ���� ������ĸ����
a����������������ɫ��T���ʵ���ɫ��
b��T�ĵ���ͨ���Ȼ���ˮ��Һ�в����û�����
c������T�γɻ������У���Ԫ�س����ۣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����зǼ��Լ��Ĺ��ۻ��������� ��
A��Na2O2 B��CH3CH3 C��NaCl D��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ����( )
A��п����ϡ����ķ�Ӧ
B��ľ̿��O2��Ӧ
C�������������е�ȼ�շ�Ӧ
D��Ba(OH)2��H2O������NH4Cl����ķ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com