
| A. | 细口橡胶塞试剂瓶 | B. | 细口玻璃塞试剂瓶 | ||
| C. | 广口橡胶塞试剂瓶 | D. | 广口玻璃塞试剂瓶 |
科目:高中化学 来源: 题型:选择题
| A. | 仅④⑤ | B. | 仅③④⑥ | C. | 仅⑥⑦ | D. | 仅①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
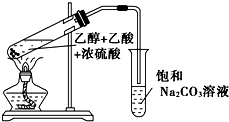 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0、△S<0 | |
| B. | 使用催化剂能够降低化学反应的反应热(△H) | |
| C. | 由Ka(HCN)<Ka(CH3COOH)可说明在相同条件下,氢氰酸的酸性比醋酸弱 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通常用小黑点来表示电子的多少 | |
| B. | 小黑点密表示在该核外空间的电子数多 | |
| C. | 小黑点密表示在该核外空间的单位体积内电子出现的概率大 | |
| D. | 通常用小黑点来表示电子绕核作高速圆周运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔与酸性高锰酸钾溶液的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在镍作催化剂、加热的条件下苯与氢气的反应 | |
| D. | 在浓硫酸作用下,苯在55℃左右与浓硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废弃物切成碎片,混在垃圾中填埋于土壤中 | |
| B. | 将废弃物焚烧 | |
| C. | 将废弃物加工成防水涂料或汽油,以节约资源 | |
| D. | 将废弃物倾倒在海洋中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12 mol•L-1 | B. | 0.1 mol•L-1 | C. | 1.2 mol•L-1 | D. | 1.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)≈10-9 mol/L | B. | pH=9 | C. | pH≈7 | D. | c(OH-)≈10-5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com